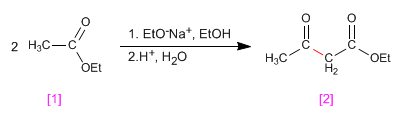TEORÍA DE ÉSTERES
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 254534
Los ésteres proceden de condensar ácidos con alcoholes y se nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo unido al oxígeno.
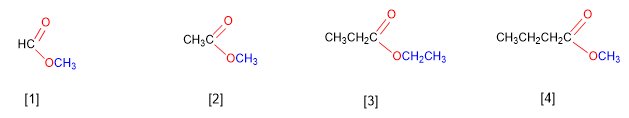
[1 ] Metanoato de metilo
[2 ] Etanoato de metilo
[3 ] Propanoato de etilo
[4 ] Butanoato de metilo
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 114640
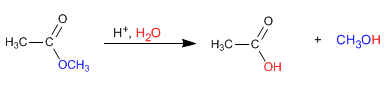
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes.
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 118674
Los ésteres se hidrolizan en medios acuosos, bajo catálisis ácida o básica, para rendir ácidos carboxílicos y alcoholes. La hidrólisis básica recibe el nombre de saponificación y transforma ésteres en carboxilatos.
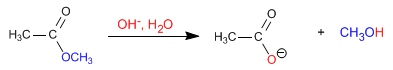
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 60143
Las lactonas son ésteres ciclicos y se hidrolizan de forma análoga a los ésteres no cíclicos, formando compuestos que contienen grupos ácido y alcohol.
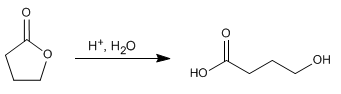
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 54465
Los ésteres reaccionan con alcoholes en medios ácidos reemplazando su grupo alcoxi por el alcohol correspondiente, como puede observarse en la siguiente reacción. Esta reacción se denomina transesterificación.
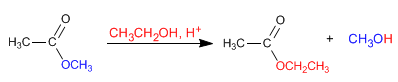
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 39703
Los ésteres transesterifican en presencia de alcóxidos, según al reacción:
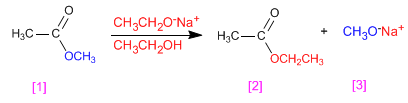
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 39648
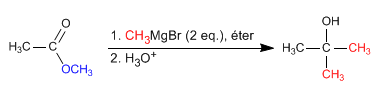
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 57904
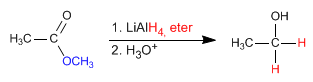
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 50331
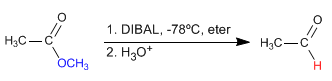
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 28626
Los ésteres tienen en su posición a hidrógenos ácidos con pKa=25, que pueden ser sustraidos empleando bases. La base conjugada es un enolato de éster, especie muy nucleófila que ataca a un variado número de electrófilos.
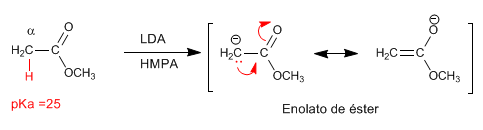
- Detalles
- Germán Fernández
- TEORÍA DE ÉSTERES
- Visto: 70055
Cuando un éster con hidrógenos a se trata con con un equivalente de base (alcóxido) condensa para formar un producto de la familia de los 3-cetoésteres. Este tipo de reacción es conocida como condensación de Claisen.