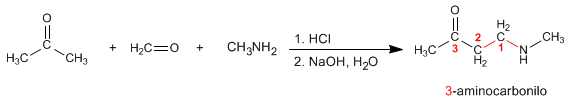TEORÍA DE AMINAS
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 183618
Regla 1. Las aminas se pueden nombrar como derivados de alquilaminas o alcanoaminas. Veamos algunos ejemplos.
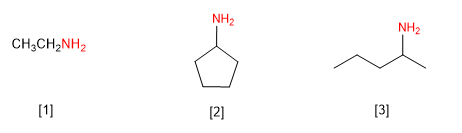
[1 ] Etilamina (Etanamina)
[2 ] Ciclopentilamina (Ciclopentanamina)
[3 ] (Pent-2-il)amina (Pentan-2-amina)
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 152616
Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 89446
Las aminas presentan hidrógenos ácidos en el grupo amino. Estos hidrógenos se pueden sustraer empleando bases fuertes (organometálicos, hidruros metálicos) formando los amiduros (bases de las aminas).
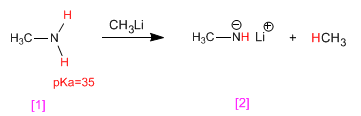
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 86996
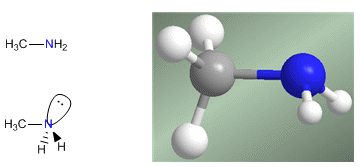
Las aminas son compuestos nitrogenados con estructura piramidal, similar al amoniaco. El nitrógeno forma tres enlaces simples a través de los orbitales con hibridación sp3. El par solitario ocupa el cuarto orbital con hibridación sp3 y es el responsable del comportamiendo básico y nucleófilo de las aminas.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 64961
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 62954
Los nitrilos se pueden preparar por reacción de haloalcanos con cianuro de sodio. La reducción de nitrilos con LiAlH4 produce aminas.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 48000
La reacción de haloalcanos primarios y secundarios con azida de sodio produce alquilazidas, que por reducción con LiAlH4 dan lugar a amidas.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 50554
Las amidas se reducen con LiAlH4 para formar aminas. El número de carbonos de la amina final es igual al de la amida de partida.
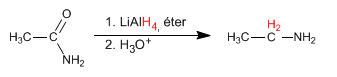
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 46919
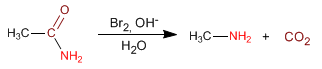
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 69279
La síntesis de Gabriel permite obtener aminas primarias a partir de haloalcanos, sin que se formen mezclas de aminas secundarias y terciarias.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 65967
La aminación reductora consiste en formar una imina, a partir de aldehídos o cetonas y aminas, que se reduce en una etapa posterior a amina. Esta reducción puede realizarse con $H_2$ catalizado por Niquel o bien con $NaBH_3CN$.
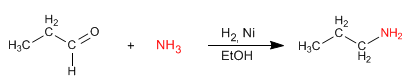
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 38602
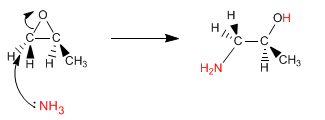
Los epóxidos (oxaciclopropanos) abren por ataque de nucleófilos, debido a la importante tensión del anillo. Si el nucleófilo empleado es amoniaco se obtiene un $\beta$-aminoalcohol. También puede obtenerse este tipo de producto abriendo el epóxido con azida de sodio, y reduciendo la azida en una segunda etapa.
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 78740
La eliminación de Hofmann permite convertir aminas en alquenos. Es una reacción regioselectiva que sigue la regla de Hofmann, formando el alqueno menos sustituido mayoritariamente.
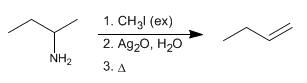
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 48678
La eliminación de Cope permite obtener alquenos a partir de aminas terciarias. La reacción consiste en oxidar la amina terciaria, formando un N-óxido de amina, que por calentamiento elimina de forma intramolecular, originando el alqueno.
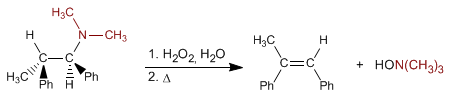
- Detalles
- Germán Fernández
- TEORÍA DE AMINAS
- Visto: 54437
Mannich prepara 3-aminocarbonilos a partir de aminas primarias o secundarias, metanal y un carbonilo enolizable. Veamos un ejemplo: