¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
-
Abdul Alhazared
-
 Autor del tema Autor del tema
-
Mensajes: 438
-
-
|
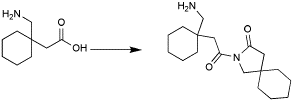
Como lograrían la siguiente síntesis:
Muchas veces se necesita obtener un producto a partir de una materia prima en especial, con un poco de observación se puede llegar a una solución sencilla, espero que varios usuarios den una respuesta.
Nota: Se pueden usar otras materias primas, pero el aminoácido que coloque debe usarse.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
|
|
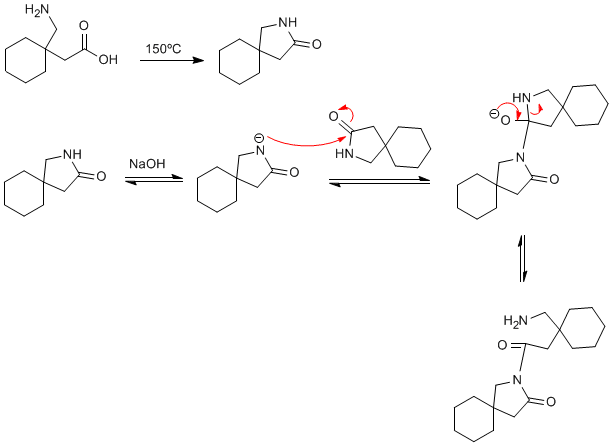
Hola Abdul, te propongo un camino basado en la condensación de dos amidas en un medio básico. No tengo datos sobre el rendimiento de esta condensación.
SAludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Wilbertrivera
-

-
Mensajes: 1647
-
-
|
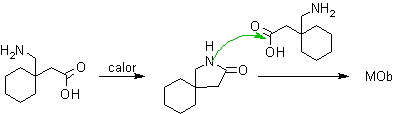
Hola Germán..
La síntesis que propones es muy elegante.
Abdul, ¿Existe alguna observación a esta otra alternativa?.
Saludos.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Abdul Alhazared
-
 Autor del tema Autor del tema
-
Mensajes: 438
-
-
|
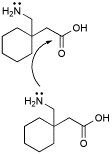
En ambas opciones me parecería que habría una competencia entre la condensación de dos moléculas de la materia prima.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
|
|
Hola Abdul, la reacción intramolecular es más favorable que entre moléculas y siempre puedes minimizar la competencia aumentando la dilución.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
pregunton
-

-
Mensajes: 169
-
-
|
INTRAMOLECULAR CONTRA INTERMOLECULAR
En la reacción intramolecular los grupos reaccionantes están más próximos y por tanto la probabilidad de encontrarse y reaccionar será mayor. Aunque hay que tener en cuenta lo siguiente:
*El efecto de aproximación,que tiene en cuenta la aproximación o cercanía de los grupos reactivos explica experimentalmente aumentos de velocidades de reacción de (1-100).
*El efecto de orientación, que tiene en cuenta la orientación/disposición espacial de las sustancias reaccionantes,explica aumentos de velocidades de (1-100)
*El efecto de orientación de los orbitales de los átomos reaccionantes, que consiste en la orientación de los orbitales electrónicos de los grupos reaccionantes, permitiendo un solapamiento máximo entre ellos. Así pues, la orientación de orbitales puede explicar aumentos de velocidad de reacción, hasta del orden de (1-10.000.000), y que teniendo en cuenta los dos efectos anteriores el orden podría aumentar hasta (1-100.000.000.000).
O sea que en términos generales la reacción intramolecular se ve favorecida siempre y cuando cumpla con los efectos citados, pero que en \"términos generales\" repito es casi siempre más favorecida que la intermolecular. La dilución te aumentará las distancias de choques entre reactivos favoreciendo la intramolecular.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
Tiempo de carga de la página: 0.437 segundos
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?