¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
-
Carla Albornoz
-
 Autor del tema Autor del tema
-
Mensajes: 2
-
-
|
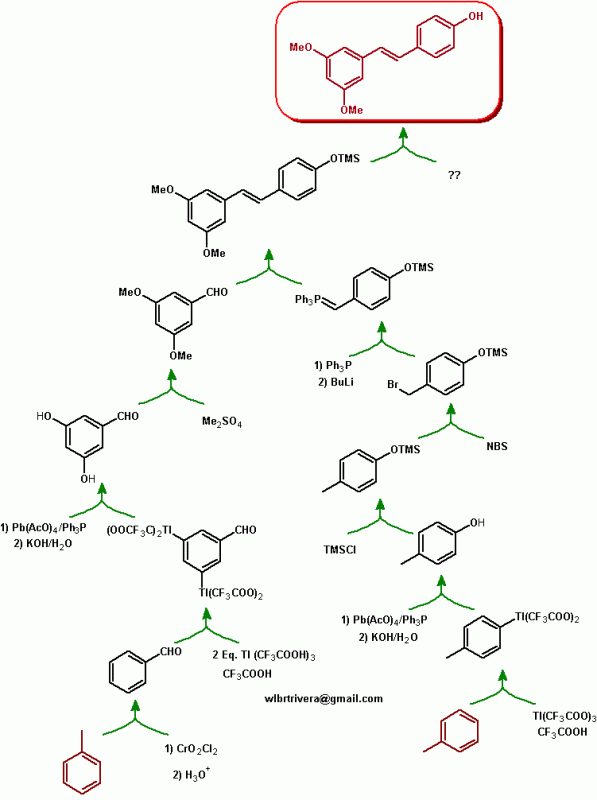
Hola tengo dudas sobre el método utilizado para la síntesis de una molécula a partir de tolueno adjuntaré imágenes
1. Mi primera duda es al momento de reducir el grupo nitro también se reducirá el ac. Carboxilico?
2. El grupo OTMS pasaría a un alcohol con ácido sulfúrico en caliente?
Si existe un mejor método para la síntesis agradecería mucho que me dijeran, gracias!
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
|
|
Hola, bienvenida al foro.
El Sn/HCl es un reductor suave que no afecta al grupo ácido.
La protección del alcohol puedes hacerla formando un éter de silicio o de bencilo. Los éteres de silicio requieren fluoruro para desproteger, así que creo que aguantará las condiciones de reacción.
Creo que la formación del doble enlace podrías hacerla con la reacción de Wittig. En vez de un haluro de ácido y un magnesiano prepara un iluro y un aldehído.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Wilbertrivera
-

-
Mensajes: 1647
-
-
|
Hola forera..
Al margen de las observaciones y sugerencia que te hace Germán, puedo señalarte que el ácido benzoico, por la presencia del grupo desactivante COOH, sólo tiene un rendimiento del 26% en la sulfonación, por otro lado un cloruro de benzoilo o alcanoilo, reacciona con el Grignard para formar un alcohol terciario y no una cetona, la reacción se puede hacer con un orgametálico de Cd o de Gilmann para obtener la cetona. En toda síntesis uno debe buscar formar un único producto y evitar la formación de isomeros que es lo que más dificultad el trabajo en el laboratorio, separar isómeros no siempre es fácil.
De modo que te hao un sugerencia, utilizando las reacciones de talación de los compuestos aromáticos que son regioespecíficas.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Worki
-

-
Mensajes: 70
-
-
|
Hola Wilbert.
Para formar el p-cresol podrías nitrar el tolueno, reducir,formar la sal de diazonio e hidrolizar. Aumentaría el rendimiento?
Y en la otra vía podrías sulfonar el tolueno y luego con NaOH obtendrías el diol, lo ves bien?
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Wilbertrivera
-

-
Mensajes: 1647
-
-
|
Hola Worki.
La nitración o sulfonación del tolueno produciría los isómeros orto y para sustituidos. Precisamente por ello que les propongo utilizar la reacción de talación, que el caso del toluelo forma un único producto el compuesto talado en para y en el caso del benzaldehido, se obtiene sólo el isómero talado en meta a una temperatura de 73°C, aspecto que mejora el rendimiento global de la síntesis.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Carla Albornoz
-
 Autor del tema Autor del tema
-
Mensajes: 2
-
-
|
tenia entendido que el uso de reactivo de Grignard con Haluro de benzoilo daba una cetona, ycuando era con 2 moles de grignard con el haluro daba alcohol
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
Tiempo de carga de la página: 0.733 segundos
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?