¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, PAs, TGs y exámenes resueltos en vídeo. Soporte para dudas por WhatsApp. Coste 30 €/mes.
Más información en www.foroquimico.com
-
Clob
-
 Autor del tema Autor del tema
-
Mensajes: 6
-
-
|
Saludos a todos:
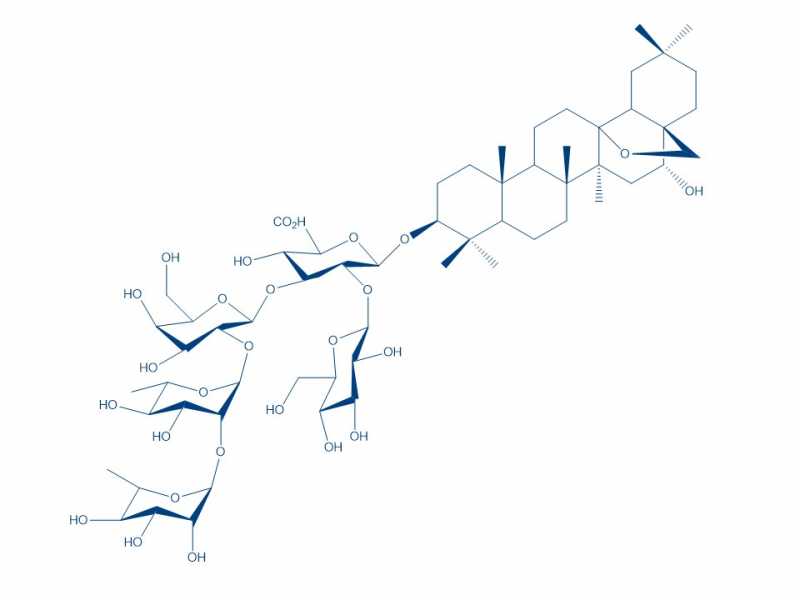
Quiero ver si me pueden ayudar, necesito proteger el OH que está libre en el triterpeno y después hidrolizar los carbohidratos para quedarme con el. Sé que al proteger, se protegen todos los OH de los carbohidratos. Pensé en acetilar pero he leído que con hidrólisis suaves solo se rompe el acetilo y no los carbohidratos. Por otro lado me interesa mantener el puente -O- que se encuentra en el triterpeno.
Necesito si alguien me podría decir que estrategia sería mejor para proteger lo OH y que al momento de hidrolizar no se hidrolice el OH protegido del triterpeno y que también con la hidrólisis no se libere el puente del biciclo que está en el mismo triterpeno.
He pensado hacerlo con OBn pero las condiciones para formarlo (como usar NaH) no se si rompan dicho puente, lo mismo que con la hidrogenación para romper la protección.
De antemano les agradezco
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
Última Edición: por Clob. Razón: Insertar imagen
|
-
badman
-

-
Mensajes: 397
-
-
|
Hola,
El alcohol que quieres proteger es secundario,por otro lado los carbohidratos.
Carbohidratos OH posiciones 1,2 solo cis Me2C(OMe2) tos
OH 1,3 tanto cis como trans PhCHO ZnCl2
El TBSCl lo podrías utilizar para alcoholes primarios pero ya los he protegido con lo anterior.
Ahora llega lo complicado todos son ciclos de 6por lo tanto habrá que ver q estructura es la más estable para ver cual es la re actividad sobre uno u otro.
Créo que todos los OH de los carbohidratos que me quedan serían ecuatoriales y secundarios. Mientras que el OH del esteroide es axial así que creo que ese podría ser un elemento diferenciador.Pero deberás buscar el reactivo o que otro forero intervenga
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
badman
-

-
Mensajes: 397
-
-
|
Q me olvide de decírtelo que sí es el axial más reactivo que los ecuatoriales entonces protegelo con silicio utiliza para proteger los átomo a de carbohidratos con Bn,MOM,MEM y luego desproteje el OH de silicio con Reactivo de F
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Clob
-
 Autor del tema Autor del tema
-
Mensajes: 6
-
-
|
Hola "badman":
Gracias por tu explicación, la tomaré en cuenta. De todas maneras seguiré buscado
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
badman
-

-
Mensajes: 397
-
-
|
Hola,
Pudes buscar en modern organic synthesis años intriduction.autor
Nantz
Con lo de axial y ecuatorial q te comente es el capítulo 2 3es el de grupos protectores.
Hay otro libro q se titula igual q profundiza más en lo q explican en el capítulo 2
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
ccv
-

-
Mensajes: 349
-
-
|
Hola Forero, Actualmente en síntesis orgánica para hidrólisis específicas de este tipo de compuestos utilizan Glicosidasas provenientes de hongos (son comerciales), aqui te dejo una referencia de estos procedimientos.
1)Libro "Enzyme Catalysis in Organic Synthesis" de Karlheinz Drauz, pag 422-423
Espero te sirva
Saludos 
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
Tiempo de carga de la página: 0.298 segundos
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?