¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
-
Orlando Q.F
-
 Autor del tema Autor del tema
-
Mensajes: 9
-
-
|
Buenas tardes estimados, me gustaría saber por qué en la hidrólisis ácida de un haluro de alcanoilo el anión halógeno es el grupo saliente y no el agua, ya que como se sabe el agua es mejor grupo saliente que el anión halógeno.
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
Begoenlared
-

-
Mensajes: 69
-
-
|
Buenas!!
Los haluros de alcanoílo son los derivados de ácido más reactivos, según tengo entendido la reacción de hidrólisis de los haluros de alcanoílo no necesita catalizador y en agua y a temperatura ambiente la reacción es rápida. Al originarse HCl (en el caso del cloruro de alcanoílo) se suele llevar a cabo en presencia de una base para su neutralización y así evitar reacciones secundarias. El mecanismo de esta hidrólisis es de adición eliminación y el agua actúa como nucleófilo.
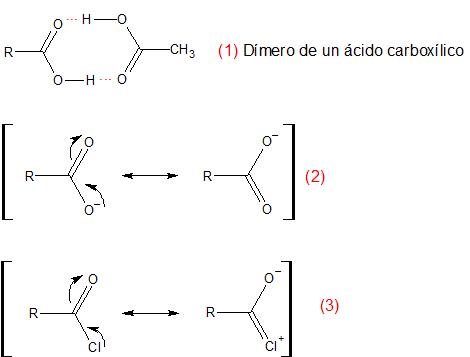
Yo creo que la formación del ácido carboxílico estará favorecida por la mayor estabilidad que presenta en medio acuoso; debido a la formación de puentes de hidrógeno y dímeros unidos por dos puentes de hidrógeno (1).
Además al ser un ácido, aunque débil (K a entre 10 -4 y 10 -5) estará poco disociado, pero los iones carboxilatos formados están estabilizados por resonancia (2), sin embargo la estructura estabilizante formada por el cloruro de alcanoílo es poco importante (3)
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
Tiempo de carga de la página: 0.289 segundos
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?