 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
-
Detalles
-
Germán Fernández
-
AZUFRE, FÓSFORO Y SILICIO
-
Visto: 19829
Los tioles se caracterizan por contener el grupo funcional -SH. Se nombran terminando el nombre de la cadena principal en -tiol, de forma análoga a los alcoholes cuya terminación es -ol
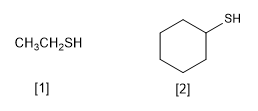
[1 ] Etanotiol
[2 ] Ciclohexanotiol
Los tioles presentan una mayor acidez que los alcoholes debido al mayor tamaño del azufre en comparación con el oxígeno. Los valores de pKa se sitúan en torno a 10 - 11, frente a los alcoholes que tienen valores compendidos entre 16-18.
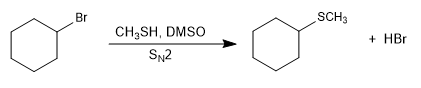
Sin embargo, el mayor tamaño del azufre favorece su polarizabiidad y en consecuencia su nucleofilia. Los tioles son mucho mejores nucleófilos que los alcoholes, mejorando aún más su nucleofilia mediante la desprotonación.
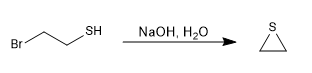
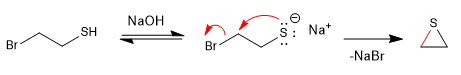
Las reacciones de tipo SN2 se vuelven más rápidas en presencia de un medio básico que genera la sal de l tiol (tiolato).
Mecanismo:
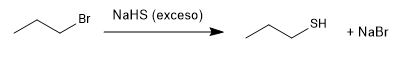
La preparación de los tioles se realiza a partir del hidrogenosulfúro de sodio y un haloalcano primario o secundario.
El exceso de hidrogenosulfuro trata de minimizar la reacción secundaria por la que el propanotiol vuelve a atacar al bromuro de propilo para dar un tioéter.
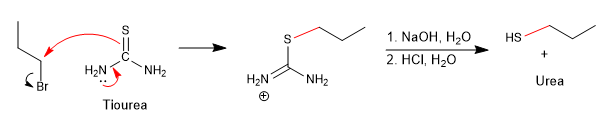
Una forma de evitar esta reacción secundaria es utilizar tiourea en combinación con un haloalcano.
Otro método de síntesis consiste en la reacción de magnesianos con azufre elemental.

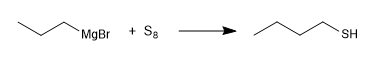
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?