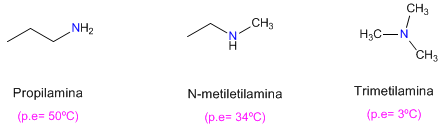
Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
Las aminas presentan puntos de fusión y ebullición más bajos que los alcoholes. Así, la etilamina hierve a 17ºC, mientras que el punto de ebullición del etanol es de 78ºC.
