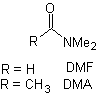Reacciones de Enoles y Enolatos
Las reacciones aldólicas y las denominadas reacciones de
condensación de compuestos carbonílicos y otros de este tipo, que pueden formar estructuras enólicas
y enolatos, participan de un gran grupo de reacciones importantes que permiten comprender
la existencia de un número inmenso de moléculas producto de la interacción de
enoles o enolatos con una serie de grupos electrófilos.
El estudio de este tipo de reacciones ha permitido constatar
y establecer la existencia de dos mecanismos de reacción por los que
transcurren, como se pasa a explicar a continuación:
A)
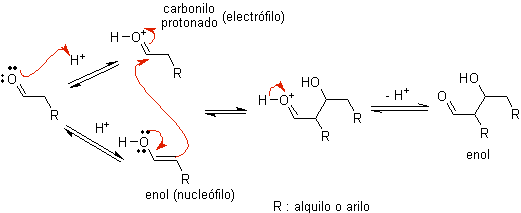
Cuando se usa ácido como catalizador, inicialmente el compuesto
carbonílico se protona y luego tautomeriza a su forma enólica, que es un nucleófilo en el carbono alfa al
grupo carbonilo. El mismo medio ácido es suficiente para activar el grupo
carbonilo de otra molécula, haciéndolo altamente electrofílico, lo que genera
condiciones óptimas para producir un compuesto carbonílico insaturado.
La reacción normalmente transcurre hasta la deshidratación del enol formado, catalizado por el mismo ácido de la reacción.
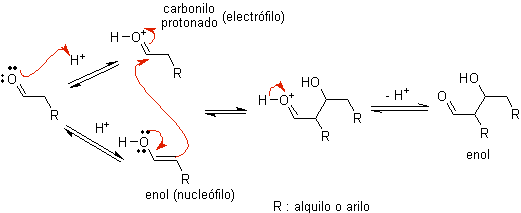
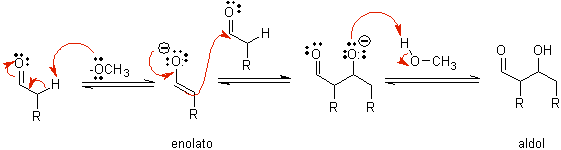
B) Cuando el catalizador es una base, como el alcóxido, la reacción del tipo
aldólico procede vía el ataque nucleofílico del enolato estabilizado por
resonancia al grupo carbonilo de otra molécula.
Por deshidratación del aldol,
catalizada por base se forma el producto final deshidratado
Como en el anterior caso, la deshidratación catalizada
por bases
(algunas veces escrita en un solo paso), permite controlar la reacción y
producir un producto final deshidratado. En algunos casos, la formación de
enolatos es irreversible.
Como se ve sólo se
requiere una cantidad catalítica de base en algunos casos, el procedimiento más
usual es usar una cantidad estequiométrica de base fuerte tal como el LDA
o NaHMDS.
En este caso, la formación de enolato es irreversible, y el producto aldólico
no se forma hasta que el alcóxido metálico del producto aldólico es protonado
en un paso posterior.
Equivalentes
sintéticos de varios enoles y enolatos
|
enolato |
azaenolato |
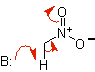
nitroalcano enolato |
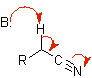
nitrilo enolato |
|
|
|
|
|
|
éster, amida |
Imina |
Nitroalcano |
Nitrilo |
|
enol
|
Enol éter |
Enol éster |
Silil enol éter |
enamina |
Alquilación de
enoles y enolatos:
La alquilación de enolatos, corresponde mayormente a una
reacción de sustitución nucleofílica con haluros de alquilo y epóxidos. En esta
reacción los haluros de alquilo y bencilo primarios, son buenos para la
alquilación, los haluros de alquilo secundario sólo en algunos casos y los
haluros de alquilo terciarios, básicamente no reaccionan con los enolatos, porque
la reacción transcurre por un mecanismo de sustitución nucleofílica bimolecular
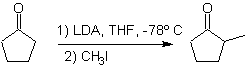
Por
otro lado, la velocidad de la alquilación es incrementada por la polaridad de
los solventes que se utilizan como medio de reacción.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TEA |
|
NaHMDS |
|
DIPEA
|
|
|
|
|
|
|
|
Cy2BCl |
|
Bu2BOTf
|
|
|
Alquilación de
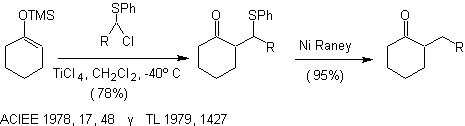
silil enoléteres, catalizada por ácidos de Lewis. Alqulación SN1


Alquilación de enolatos de compuestos a, b insaturado carbonílicos:
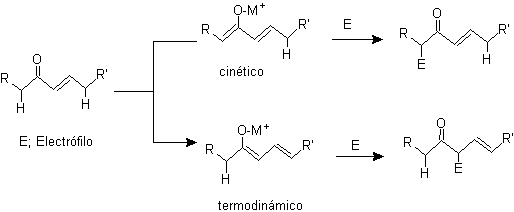
¨
g-alquilación
de cetonas insaturadas en a,b
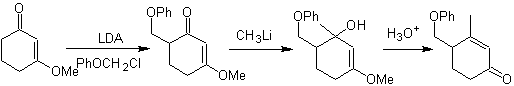
Alquilación de
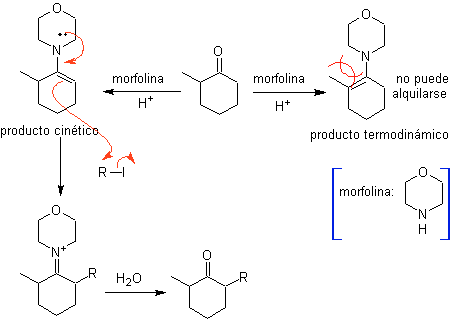
enaminas.
Se controla la monolaquilación y la formación del producto cinético, aprovechando el efecto estérico, para lo cual se tiene que utilizar una amina secundaria, voluminosa como la morfolina.
Por otro lado, las enaminas
quirales, producen en la alquilación, cetonas alfa sustituidas también
quirales
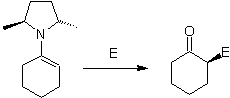
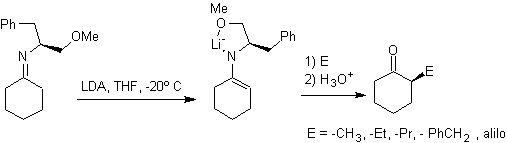
Alquil iminas: Las iminas, isoelectrónicas con las cetonas, pueden
transformarse en enaminas, que posteriormente pueden ser alquiladas o
reaccionar con un reactivo electrófilo.
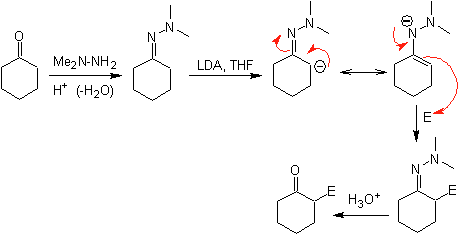
¨
Los aniones de las hidrazonas son mucho más reactivos que los
correspondientes enolatos de aldehídos o cetonas.
¨
Existe un inconveniente, puesto que puede existir dificultad
en la hidrólisis final.
¨
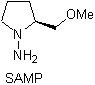
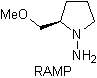
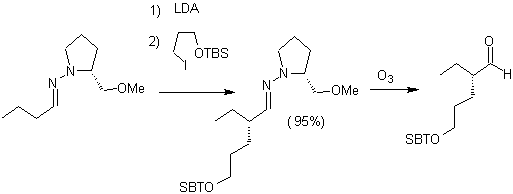
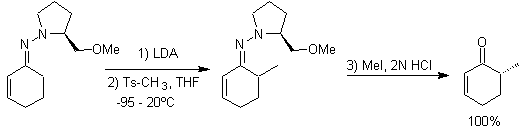
Las hidrazonas quirales son utilizadas para la alquilación
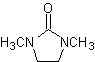
asimétrica (las hidrazonas RAMP/SAMP, son utilizadas en la síntesis asimétrica)
|
|
|
|
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?