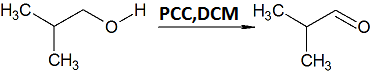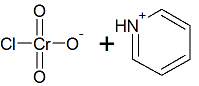Hola.
Le he estado dando vueltas al posible mecanismo, y la verdad es que ando un poco perdido porque en unos sitios encuentro una cosa y en otros otra. He decidido proponer yo mismo un mecanismo y, en base a los posible fallos que pueda haber cometido, ir construyendo uno mejor hasta dar con el correcto.
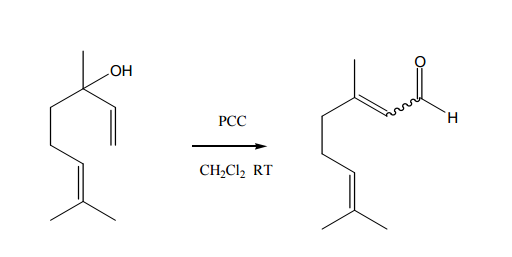
Voy a oxidar isobutanol en disolución de diclorometano y clorocromato de piridinio para producir isobutanal:
El clorocromato de piridinio se prepara con ácido clorhídrico, piridina y óxido de cromo (VI) y tiene la siguiente forma:
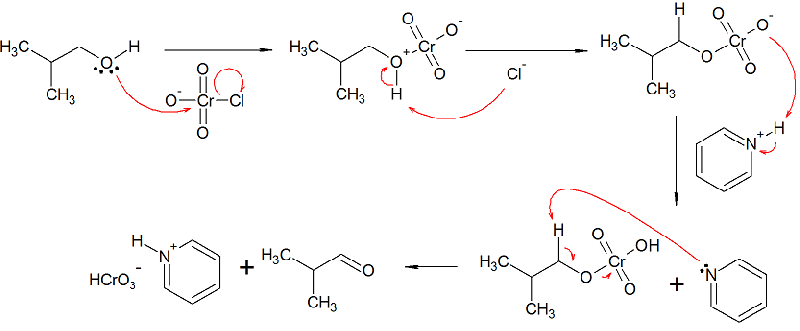
El mecanismo que he propuesto es el siguiente:
El primer paso involucra el ataque nucleófilo del grupo alcohol al clorocromato, eyectando un átomo de cloro. Esto, desde mi punto de vista, es favorable debido a que el cromo posee una carga parcial positiva, inducida por los átomos electronegativos adyacentes.
En el siguiente paso, el cloro actúa como base y desprotona el ión oxonio formado en el paso anterior. Esto, una vez mas desde mi punto de vista, es posible porque el ión piridinio se encuentra formando un enlace salino con el grupo cromato y no puede estabilizar el ion cloruro (porque además el solvente es polar aprótico y no puede solvatar los iones). Es por ello que la reacción de transferencia de protón es posible.
Una vez llegado a este punto, el átomo de oxígeno con carga negativa del cromato desprotona al ión piridinio, formando piridina y permitiendo que ésta, en un último paso, ataque al hidrógeno alfa del alcohol, propiciando una eliminación que además eyecta el grupo del cromo, produciendo porfín el aldehído deseado. Una variante de este paso sería que el grupo cromato atacase al ácido clorhídrico, siendo el cloruro una vez más el que produzca la reacción de eliminación. He decidido que esto es menos factible porque la piridina es una base más fuerte que el cloruro, por lo que la reacción será más rápida.
Al no existir agua en ningún momento, la reacción se "atasca" en este último paso, por lo que no hay hidrolización posible del grupo carbonilo.
Obviando el hecho de que mi mecanismo no es más que un prototipo y que de hecho, puede ser incorrecto, se me ocurren varias preguntas:
1-Si el PCC se forma con ácido clorhídrico.... ¿No se introduce agua ya en el mismo paso de formación del reactivo?
2-El subproducto formado en el último paso, además, viene acompañado de acido clorhídrico... ¿Pueden estos subproductos, de alguna manera, reaccionar para "estropear" la reacción global?
3-La elección del solvente: Yo he propuesto que el ion piridinio esta localizado en el enlace iónico con el cromato porque el diclorometano no puede solvatar iones... ¿es esto correcto?
Para finalizar, decir que He decidido seguir con el tema hasta el final por simple curiosidad científica

y dar las gracias de antemano a todo aquel que se anime a ayudarme. Espero recibir posibles variantes del mecanismo.
Un saludo.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?