SÍNTESIS DE LA PIRIDINA Y SUS DERIVADOS
|
La piridina es un líquido incoloro de olor desagradable, presenta en su estructura un heterociclo de seis eslabones, y tiene un carácter aromático; le sigue en importancia a la quinoleína debido a que se encuentra presente en numerosos alcaloides y fármacos de diversos usos. |
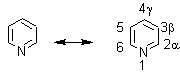 |
|
|
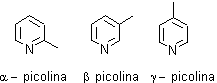
Es muy soluble en agua, con un pKa 5.17 de punto de ebullición 115º C y es una base débil, pKa del amoníaco 9.2 de la piperidina 11.2 y un poco más fuerte que la anilina cuyo pKa es 4.6. Normalmente se lo extrae del alquitrán de hulla conjuntamente a las metilpiridinas, denominadas picolinas. |
 |
|
1. Reacciones químicas de la piridina
La piridina debido a su alta estabilidad no es afectada con los agentes oxidantes comunes, sin embargo se reduce con mayor facilidad que el benceno, para formar la correspondiente piperidina.
Por otro lado, se puede afirmar que la reactividad de la piridina es equivalente a la de una anillo bencénico disustituido con dos grupos nitro en posición para, razón por la cual no todas las sustituciones electrofílicas aromáticas que se dan en el benceno, ocurren en la piridina. Así por ejemplo no se producen la alquilación y acilación de Friedel Crafts, tampoco ocurre la nitración a temperaturas moderadas y de la halogenación la única reacción significativa es la bromación.
Las estructuras de resonancia de la piridina que reciben (o toman) un sustituyente B electrófilo y que a continuación se muestran, permiten la predicción de los lugares en los cuales se producirán las reacciones de sustitución electrofílica:
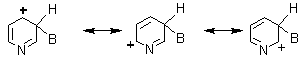
La inspección de las formas de resonancia cargadas sugiere que la densidad electrónica sobre los átomos de carbono alfa y gamma es especialmente baja; consiguientemente debe esperarse una sustitución en beta, además debido a que esta posición es la única en la que el estado de transición en la sustitución, no tiene una forma de resonancia con una carga sobre el nitrógeno trivalente.
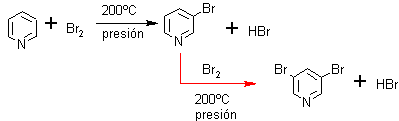
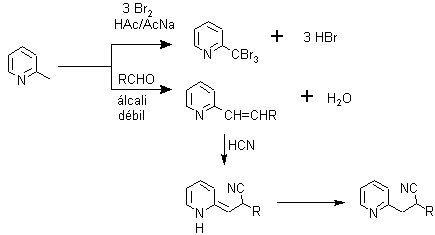
ü Halogenación. La bromación es más estereoespecífica que la cloración, porque se puede obtener sólo el derivado monobromado en beta, separable de la dibromopiridina por destilación.
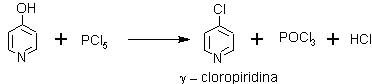
Sin embargo, también se pueden obtener derivados clorados, a partir de las alfa o gamma hidroxipiridinas
ü Sulfonación. La piridina puede sulfonarse a temperaturas altas utilizando como catalizador sulfato de vanadio, formando ácido sulfónico, con muy buenos rendimientos; importante intermedio para la síntesis de piridinas sustituidas.

2. Síntesis y reacciones de los derivados de la piridina. La química de los grupos sustituyentes en la piridina, depende de la posición de sustitución, habiéndose arribado luego de las observaciones empíricas a las siguientes generalizaciones:
a) Los grupos funcionales sustituidos en la posición beta (3 ó 5) de la piridina, presentan propiedades aromáticas características.
b) Los grupos funcionales ubicados en las posiciones alfa o gamma de la piridina (2,4 o 6) presentan reacciones características idénticas a los que están unidos al carbono alfa de los grupos carbonilo (por ejemplo acidez de los hidrógenos).
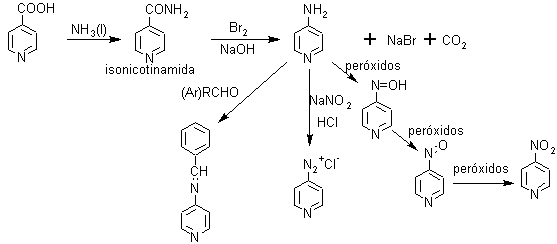
ü Ácidos piridincarboxílicos y sus derivados
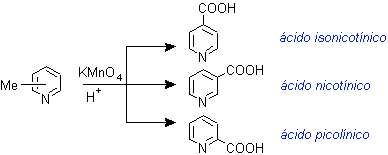
· Ácidos nicotínico, isonicotínico y picolínico
Pueden formarse por oxidación a partir de las picolinas obtenidas por extracción del alquitrán de hulla, con KMnO4/H+.
|
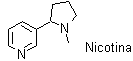
El ácido nicotínico, así como su amida, tienen propiedades de vitamina (vitamina B). Recibe ese nombre debido a que el mismo fue obtenido por oxidación de la nicotina, alcaloide muy tóxico. |
 |
El ácido nicotínico es un importante intermediario, para la preparación de vitaminas, razón por la cual tiene una producción industrial significativa, y el procedimiento más común, parte del ácido beta-sulfónico que se obtiene por Sulfonación directa de la piridina.
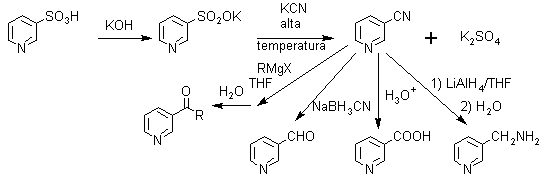
· Derivados de ácidos carboxílicos:
a) Haluros de ácido
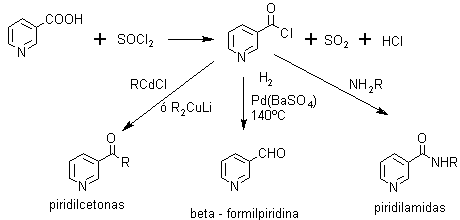
b) Formación de aminopiridinas, a partir de las amidas, por reacción de Hofmann.
Las sales de diazonio de la piridina en las posiciones 2 y 4 no permiten la inclusión de otros grupos como ocurre en el benceno, para ello el grupo diazoico debe estar ubicado en la posición beta (3). Sin embargo puede reaccionar sobre otros compuestos aromáticos, para formar colorantes azoicos.
ü Álquilpiridinas
Las distintas metilpiridinas, ya se ha dicho que se extraen del alquitrán de hulla, sin embargo las demás alquilpiridinas deben prepararse por otros procedimientos.
· Síntesis de la beta-alquilpiridina: La misma se puede conseguir por reducción del grupo carbonilo de la cetona al correspondiente grupo metileno –CH2 - , Las 2- y 4-alquilpiridinas se pueden obtener por métodos más directos.
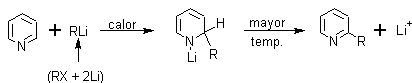
· Las 4-alquilpiridinas superiores se preparan aprovechando la acidez de los hidrógenos de un metilo sustituido en 4, haciéndolo reaccionar con Li, y este producto con un haluro de alquilo, para hacer crecer la cadena alquílica.
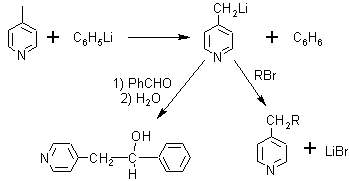
· La acidez de los hidrógenos de los grupos alquilo en la posición 2, permite que la misma reaccione de maneras distinta como puede observarse a continuación:
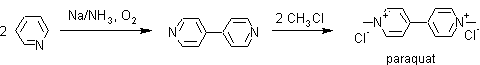
ü Reacciones de acoplamiento. Las piridinas participan de reacciones de acoplamiento, cuando la piridina es tratada con Na/NH3 y O2. Este comportamiento se ha utilizado para efectuar la síntesis del paraquat el cual es un efectivo herbicida.
Otras reacciones de acoplamiento, son catalizadas por metales como el paladio o cobre así como por el bronce:
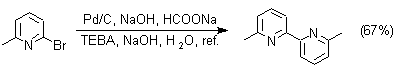
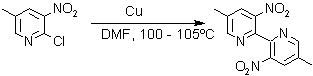
3. Síntesis de la piridina de Hantzsch. A pesar de que puede obtenerse casi cualquier derivado monosustituido de la piridina por las reacciones ya expuestas, la síntesis de derivados polisustituídos requiere, a menudo, una secuencia inicial implicando un procedimiento de ciclación, por esa razón se han estudiado muchas alternativas.
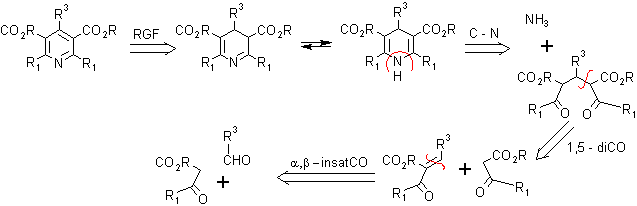
La síntesis de piridinas de acuerdo a Hantzsch, consiste en la condensación con amoniaco de un compuesto beta-dicarbonílico y un aldehído, para formar una dihidropiridina que por oxidación posterior conduce a la respectiva piridina. El camino seguido por la reacción, y la naturaleza del producto formado (dihidropiridina) depende de la cantidad relativa de los reactivos utilizados.
. Usando exceso del compuesto dicarbonílico (piridinas simétricas)
Mecanismo. Inicialmente un aldehído se combina con un compuesto 1,3 - dicarbonílico, según la reacción de Knovenagel y el compuesto α, β - insaturado resultante luego sufre una adición de Michael con el enolato de otra molécula 1,3-dicarbonilo. El medio básico para todo esto lo proporciona el mismo amoníaco o amina.
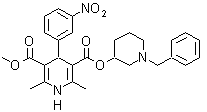
Problema 1. El Nifedipino es un fármaco denominado “antagonista del calcio”, por lo cual reduce la entrada de calcio en las células del miocardio y vasos sanguíneos. Produce vaso dilatación arterial a nivel periférico y aumenta el flujo sanguíneo coronario y la oxigenación del miocardio. Proponer un diseño de síntesis par este fármaco.
Análisis retrosintético: La simetría de los sustituyentes sobre el anillo dihidropiridínico, orienta la síntesis hacia la utilización en exceso del compuesto 1,3 – dicarbonílico, aspecto que se puede observar luego de la primera desconexión de los enlaces C – N, lo que al mismo tiempo permite visualizar la estructura del benzaldehído, con un grupo NO2, en la posición orto.
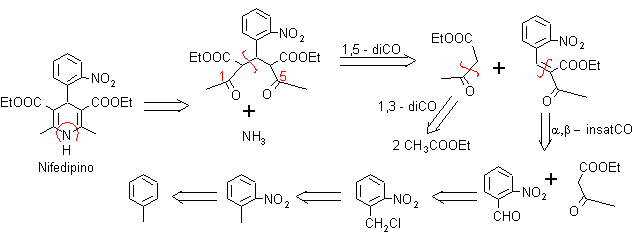
Síntesis del Nifedipino: El material de partida es el tolueno, que luego de nitrarse y
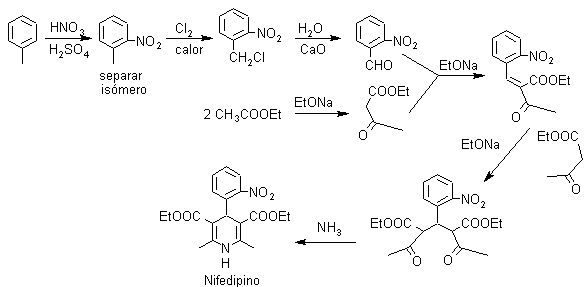
separar el isómero orto-nitrotolueno, permite halogenar el grupo metilo y luego transformarlo en aldehído, para hacerlo reaccionar con el cetoéster según Knoevenagel. Al compuesto α, β-insaturado CO formado se adiciona el enolato del cetoéster, para formar el 1,5-diCO que se cicla con el amoníaco..
. Usando exceso del aldehído (piridinas asimétricas)
El aldehído se combina de acuerdo a la reacción de Knovenagel con el 1,3 – dicarbonilo, para producir el éster a,b –insaturado que luego se combina con el enolato del aldehído por la reacción de adición de Michael. El último paso es una oxidación de la dihidropiridina formada.
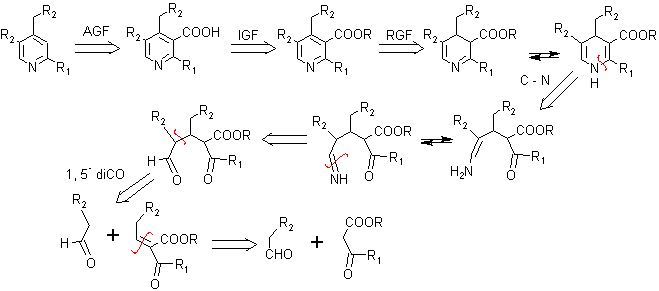
Problema 2. La CLEVIDIPINA es un bloqueador de los canales de calcio de acción ultra rápida que se está desarrollando para el control endovenoso inmediato de la hipertensión arterial. Proponer un plan de síntesis para este fármaco.
Análisis retrosintético:
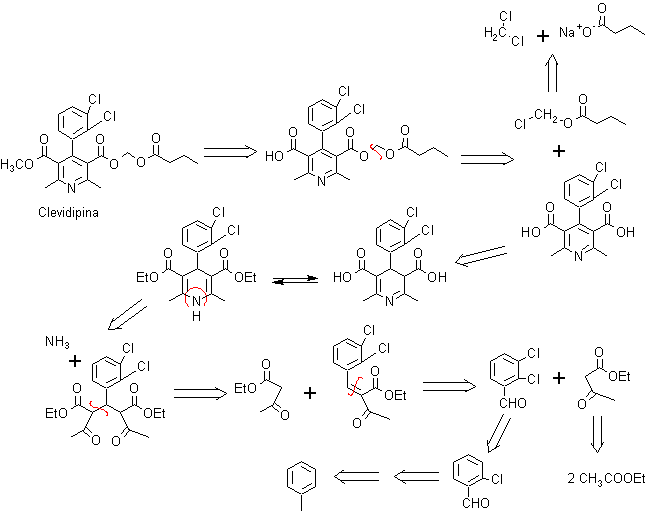
Las reacciones de la síntesis, como se ve, resultan ser recurrentes, establecido el modelo de desconexión.
4. Síntesis de piridinas por reacciones de ciclación.
ü 1,5 – Dinucleófilo como sustrato y un nucleófilo nitrogenado (amoníaco)
. Condensación de un compuesto 1,5-Dicarbonílico con amoníaco (o aminas). Esto corresponde, a la siguiente desconexión:
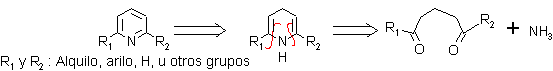
Mecanismo de la reacción:
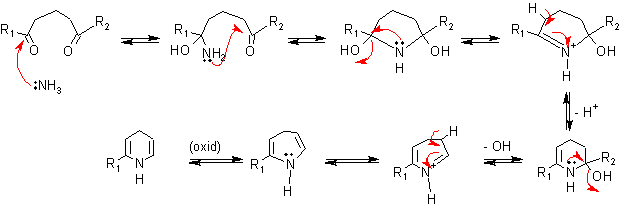 . Condensación de un compuesto 1,5 – dicarbonílico con hidroxilamina. Se puede evitar el paso de la oxidación final si se utiliza como nucleófilo una hidroxilamina; así, por pérdida de agua se obtiene la piridina.
. Condensación de un compuesto 1,5 – dicarbonílico con hidroxilamina. Se puede evitar el paso de la oxidación final si se utiliza como nucleófilo una hidroxilamina; así, por pérdida de agua se obtiene la piridina.
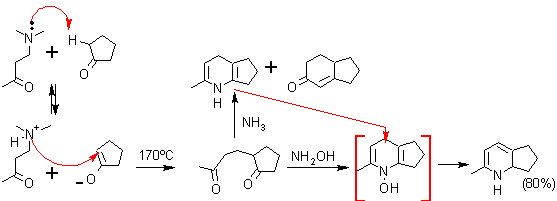
ü 1,3–Dielectrófilo como sustrato y 1,3–Dinucleófilo como reactivo. Aquí se puede contar con un conjunto de sustratos dielectrófilos y varios dinucleófilos, que pueden viabilizar la formación de una piridina multisustituída y que responde a la siguiente secuencia de desconexión:
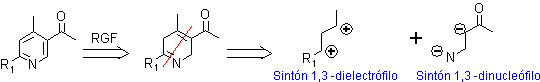
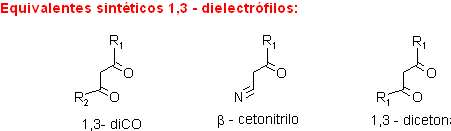
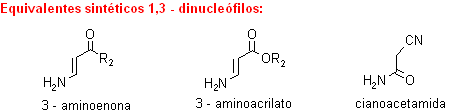
A modo de ejemplo, se verán algunas alternativas de un conjunto de combinaciones para formar derivados de piridinas.
. 1,3-dicarbonilo con 3-aminoenona (ó 3-aminoacrilato).
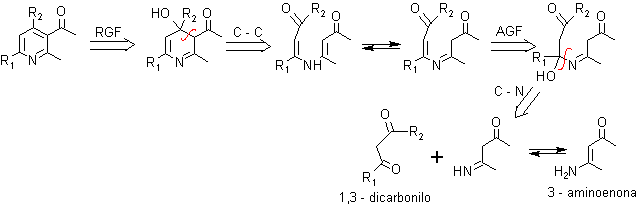
Se considera a esta síntesis como la más versátil, porque permite el acceso a piridinas no simétricas a partir de precursores relativamente sencillos.
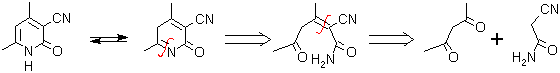
. 1,3-dicarbonilo con cianoacetamida (o su equivalente). Con la cianoacetamida, normalmente se obtienen 3-ciano-2-piridonas, reacción que es conocida como la síntesis Guareschi.
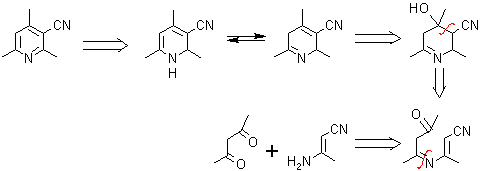 . Beta-cetonitrilo con enamina (3 - aminoenona o 3-aminoacrilato)
. Beta-cetonitrilo con enamina (3 - aminoenona o 3-aminoacrilato)
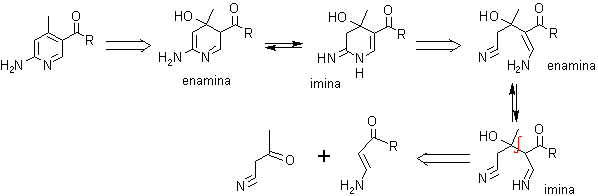
5. Síntesis de piridinas de Bohlmann – Rahtz.
Esta síntesis responde al siguiente esquema , donde EWG, es un grupo atractor de electrones como –CHO, -COR, -COOR, etc.
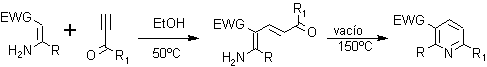
Las altas temperaturas en el paso de la deshidratación se pueden evitar mediante la realización de la condensación en condiciones ácidas y utilizando una resina como la amberlita 15.
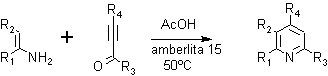
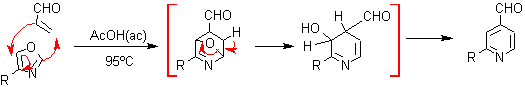
6. Síntesis de piridinas por Cicloadiciones: De igual manera, las reacciones de cicloadición de Diels Alder, entre derivados del 1,3-oxazol como dienos y diversos dienófilos, pueden obtenerse aductos intermedios que luego de eliminar el oxígeno puente formado por simple calentamiento, permiten arribar a compuestos piridínicos con sustituyentes difíciles de conseguir por otras vías, como puede verse en los siguientes ejemplos:
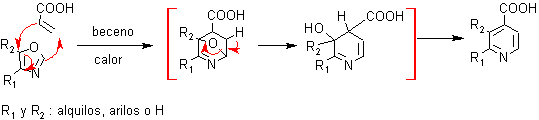
Los azadienos, también permiten formar heterociclos piridínicos, para lo cual se deberá seleccionar un dienófilo adecuado:
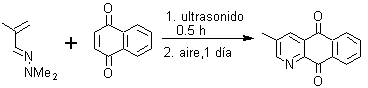

7. Proponer un análisis retrosintético para los siguientes derivados de piridina:
|
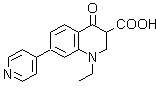
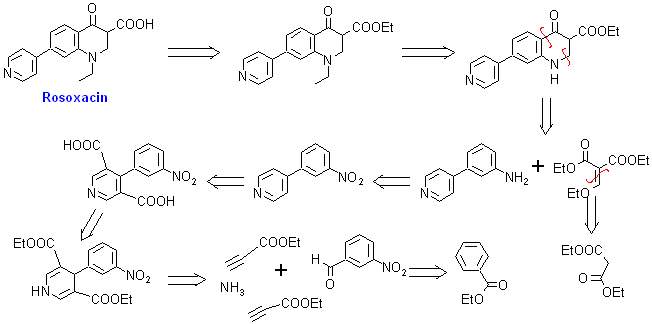
1. Rosoxacin
|
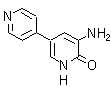
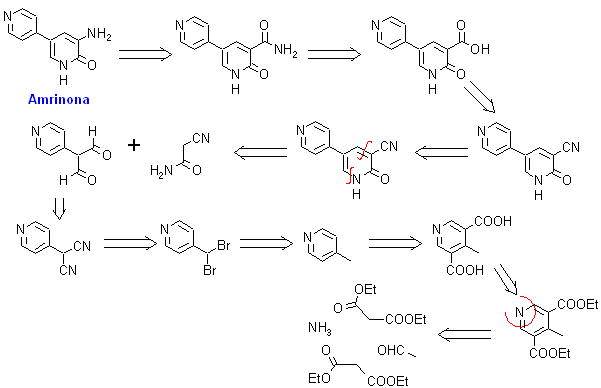
2. Amrinona:
|
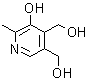
3. Piridoxina.
|
|
4. Etoricoxib
|
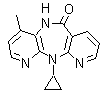
5. Nevirapina
|
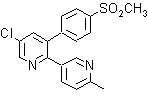
6. Benedipino (Benidipine)
|
SOLUCIONES:
1. Rosoxacin. Es un antibiótico quinolónico de primera generación, conocido también como acrosoxacin, o según su nombre comercial: Eradacil. Es utilizado para el tratamiento de infecciones del tracto urinario y otras enfermedades de transmisión sexual.
2. Amrinona. Es un agente inotrópico cardíaco positivo, que a la vez presenta actividad vasodilatadora. Su estructura y modo de acción la diferencian de los glucósidos digitálicos y de las catecolaminas. Su síntesis puede responder al siguiente análisis retrosintético:
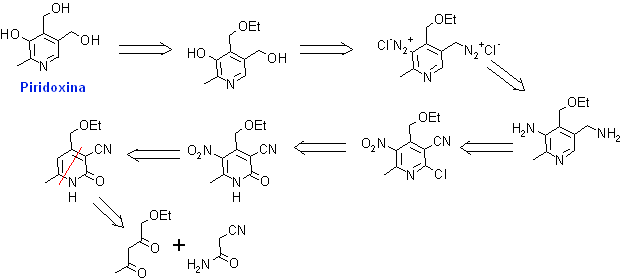
3. Piridoxina. La Piridoxina o Vitamina B6, participa en diferentes procesos del organismo, favoreciendo la digestión y el fraccionamiento de las proteínas y aminoácidos, y en menor medida de lípidos e hidratos de carbono. También participa en la síntesis de ácidos nucleicos y en la producción de glóbulos rojos sanguíneos. Su síntesis puede encarase según el siguiente análisis retrosintético:
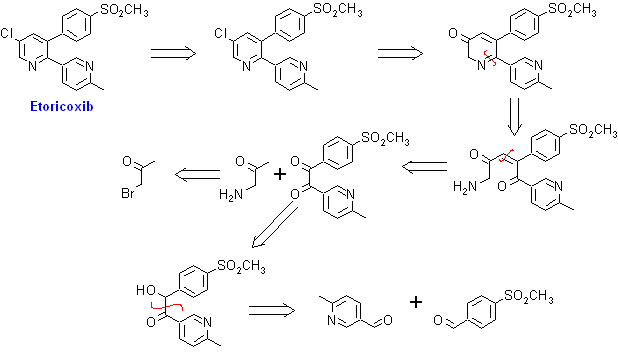
4. Etoricoxib. Comercializada como ARCOXIA(etoricoxib). Es un miembro de una clase de medicaciones para la artritis/analgesia, denominada Coxibs. ARCOXIA es un inhibidor altamente selectivo de la ciclooxigenasa-2 (COX-2).
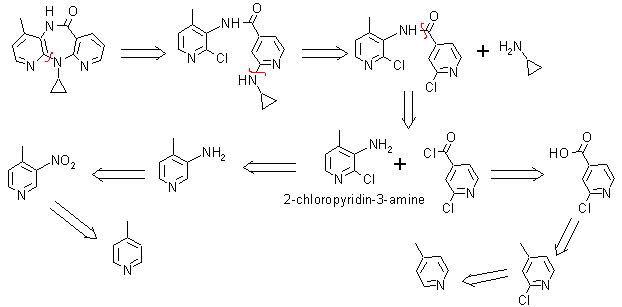
5. Nevirapina. Comercializada con el nombre de Viramune es un inhibidor de la transcriptasa reversa no análogo de los nucleósidos, empleado en el tratamiento de la infección por VIH tipo 1 y del SIDA. Se recomienda su uso, siempre en combinación con otros retrovirales.
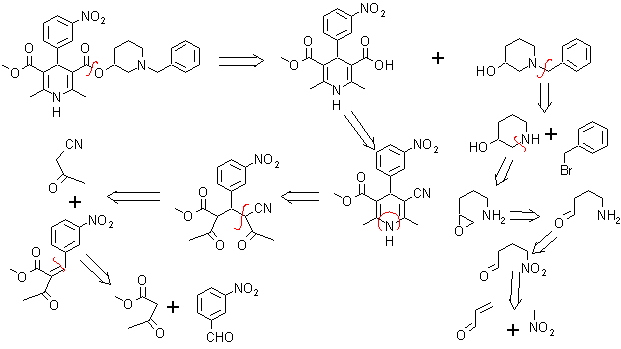
6. Benidipino (Benidipine DCI). Es también conocido como Benidipinum o clorhidrato de benidipine, es un bloqueante de los canales de calcio, pertenece a la familia de los compuestos dihidropiridínicos muy útiles para el tratamiento de la hipertensión.
BIBLIOGRAFÍA.
1. ACHESON R.M. Química Heterocíclica. Publicaciones Cultural S.A. México, 1976.
2. CASON J. Química Orgánica MOderna. URMO S.A. De Ediciones., España,1975
3. EICHER et. al. The Chemistry of Heyerocycles.
4. ESTEBAN S. et. al. Química Orgánica Heterocíclica.
5. KOUZNETSOV V. Y PALMA A. Química básica de los heterociclos y su importancia para la práctica. Editorial Universidad INdustrial de Santander UIS. 1997
6. PAQUETTE L. Fúndamentos de Química Heterocíclica. Editorial Limusa- México. 2003.