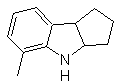
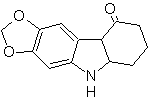
Síntesis
de INDOLES
(Por
el método de las desconexiones)
El sistema de anillos del indol se ha encontrado en muchos compuestos
naturales de gran interés químico y bioquímico, razón por la cual se afirma que es el más abundante en la naturaleza. Así, el triptófano es un
aminoácido esencial, el índigo un colorante y el ácido indolil-3-acético, una
hormona de crecimiento vegetal. Por otro lado, el interés en estas moléculas
surge de su uso farmacológico, son un ejemplo el sumatriptan (antimigrañas) y
el frovatriptan también antimigrañas.
El indol es un sólido cristalino incoloro de p.f. 52ºC, fácilmente soluble en la mayoría de los disolventes orgánicos y cristaliza en agua, tiene olor agradable y por esa razón también se lo usa como base de perfumes.
Fué preparado por primera vez en 1866 por calentamiento del oxindol con polvo de cinc y ha venido a ser un producto comercial importante. Baeyer en 1869 propuso la siguiente síntesis:
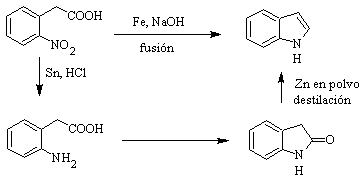
Los métodos de síntesis clásicos de indoles, son los de Fischer, Bischler,
Reissert y Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus y Dobbs.
1.
Síntesis
de FISCHER
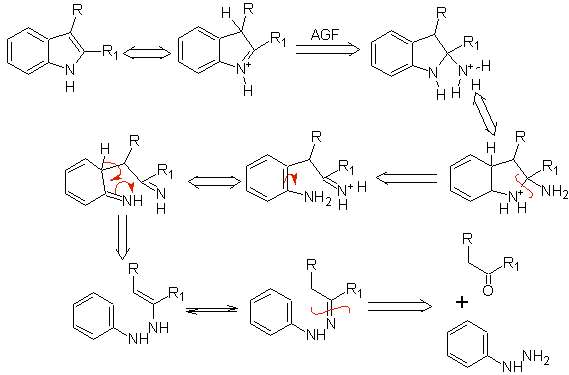
Consiste en calentar fenilhidrazonas de cetonas o aldehídos, con cloruro de
zinc anhidro, trifluoruro de boro, ácido polifosfórico, o algún otro
catalizador acido, para producir indoles. Ocurre una transposición, catalizada
por ácidos, de una fenilhidrazona con eliminación de agua y NH3. Los
grupos electrodonadores favorecen la ciclación y los electroatractores la
dificultan.
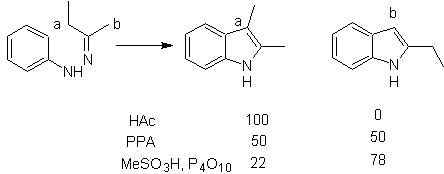
Con cetonas asimétricas, la ciclación intramolecular de la hidrazona puede
conducir a dos indoles isómeros en distintas proporciones según las condiciones
utilizadas, en medios fuertemente ácidos, puede predominar el indol menos
sustituido.
Cuando existen sustituyentes en meta, respecto al nitrógeno de la
hidrazona, la ciclación puede tener lugar en dos posiciones, que conducen a dos
indoles isómeros:
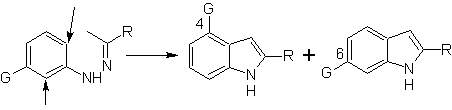
Si el sustituyente G es electroatractor, los dos isómeros (4- y 6-) se
forman aproximadamente en la misma proporción. En cambio si G es un
sustituyente electrodonador, se forma mayoritariamente el isómero sustituido en
6. El análisis retrosintético del indol formado por la síntesis de Fischer, se
puede plantear de la siguiente manera:
|
Proponer
un plan de síntesis para las siguientes moléculas:
|
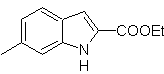
MOb 119
|
|
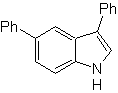
MOb 120
|
MOb
119. Análisis
retrosintético. La desconexión fundamental en los indoles que se supone,
se forman por la síntesis de Fischer, corresponde a una retro-transposición,
que se muestra en la desconexión de
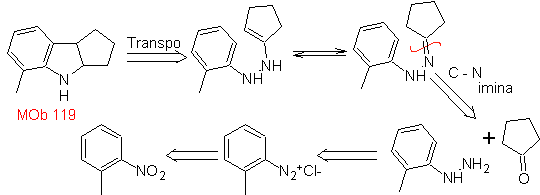
Síntesis:
A partir del orto-nitrotolueno, se genera el derivado intermedio de la
fenilhidrazina, necesaria en la síntesis de indoles de Fischer, se forma la
imina con una ciclopentanona, y por calentamiento de forma
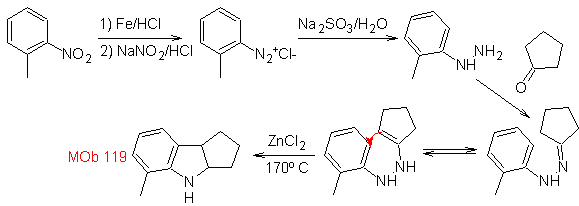
MOb
120. Análisis
retrosintético. La
retro-transposición de
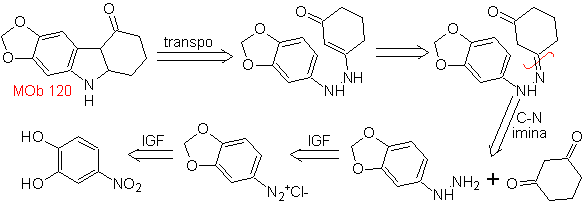
Síntesis. Se protege los
OH de la molécula de partida, formando un acetal cíclico y se reduce el grupo
nitro para luego diazotar el amino.
La reducción del diazocompuesto formado con sulfito de sodio, permite
obtener el derivado de fenilfidrazina, que se combina con la ciclohexanona, que
luego conduce a
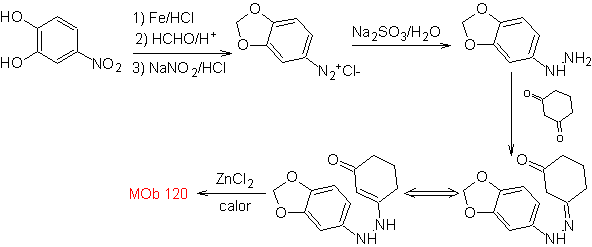
1.
Síntesis
de BISCHLER
Consiste en una ciclación, catalizada por ácidos, de una α-arilaminocetona,
que se prepara a partir de una anilina y un α-halocarbonilo. Utilizando
α-aminocetonas N-aciladas, la ciclación es más controlable y permite obtener
indoles sustituidos en el anillo heterocíclico
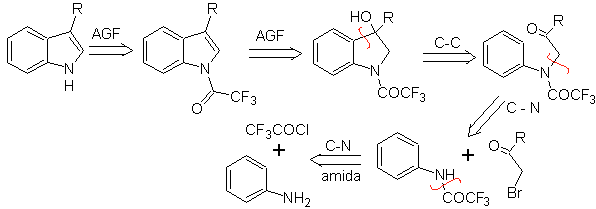
|
Proponer
un diseño de síntesis para las siguientes moléculas:
|
MOb 121
|
|
MOb 122
|
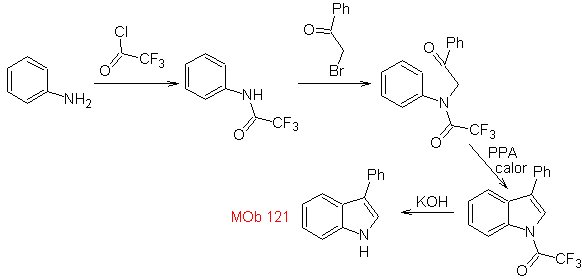
MOb 121. Análisis retrosintético.
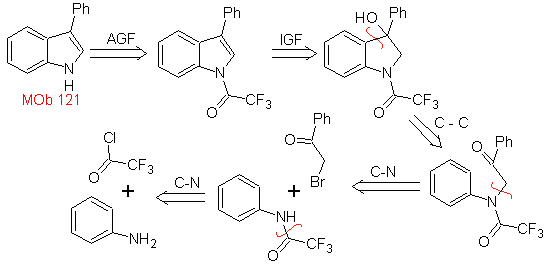
Síntesis. Partiendo de la anilina, se puede obtener la
amida requerida, que luego reaccionará con el α-bromo benzofenona, para formar
una molécula que cicla con PPA. La aplicación de una base como el KOH y calor,
se forma
MOb 122. Análisis retrosintético.
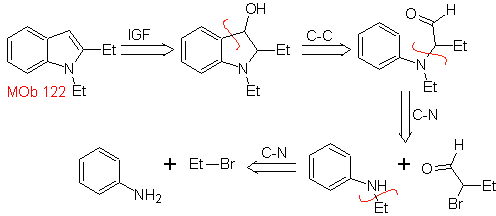
Síntesis.
Nuevamente, se inicia la síntesis de
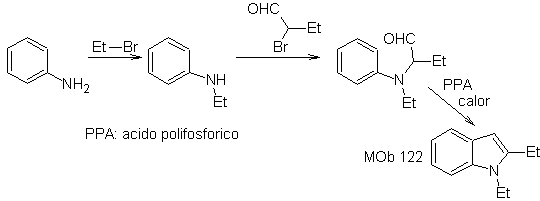
En este método es fundamental que los hidrógenos del sustituyente en la
posición orto al grupo nitro sean suficientemente ácidos, y por lo tanto el
nucleófilo esté garantizado en su formación, para combinarse con un compuesto
carbonílico.
|
Proponer un plan de síntesis
para las
siguientes moléculas:
|
MOb 123
|
|
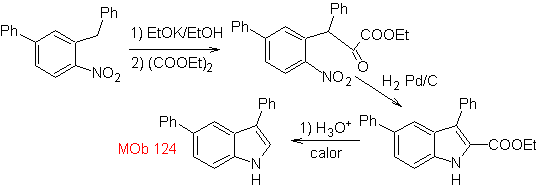
MOb 124
|
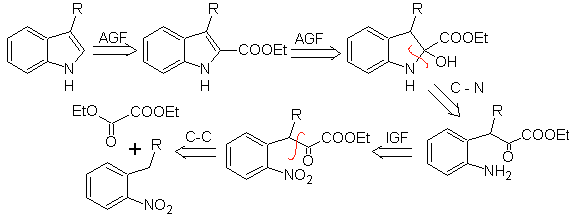
MOb 123. Análisis retrosintético.
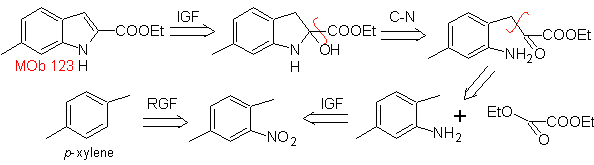
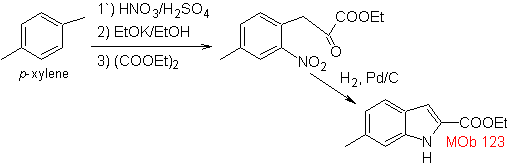
Síntesis. El p-xileno se
transforma en un nitroderivado, como el intermediario requerido, para
ciclarse, descarboxilarse y así formar
MOb 124. Análisis retrosintético.
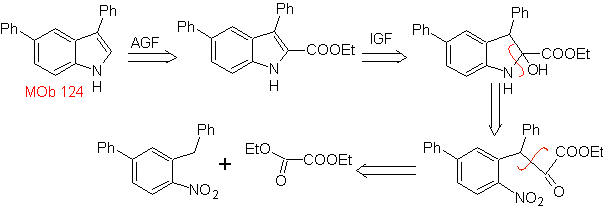
Síntesis. El material de
partida que se propone para la síntesis de
3.
Síntesis
de LEIMGRUBER- BATCHO
Al igual que en el anterior método, se tiene que garantizar la acidez del
sustituyente en la posición orto al grupo nitro, el electrófilo que se requiere
lo aporta el aminodiacetal.
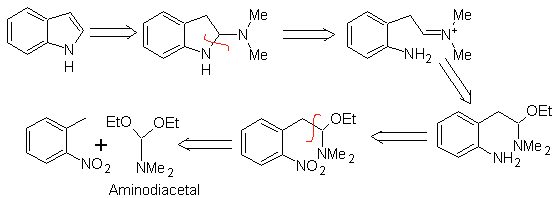
|
Proponer un plan de síntesis para las
siguientes moléculas:
|
MOb 125
|
|
MOb 126
|
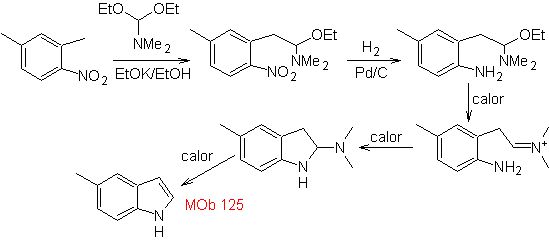
MOb 125. Análisis retrosintético. Se utiliza la estrategia de desconexión que
emerge de la síntesis de Leimgruber-Batcho, para
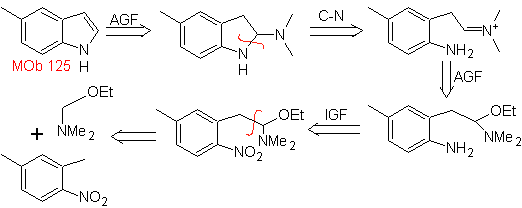
Síntesis.
El intermedio 2,4-dimetil-1-nitrobenceno, puede prepararse a partir del
benceno y continuar con las reacciones previstas en el método de
Leimgruber-Batcho, para la síntesis de
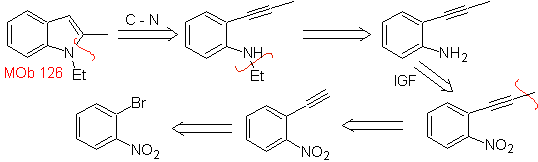
MOb 126. Análisis retrosintético. El grupo metilo en el C2 del indol,
obliga a que las desconexiones se vinculen a la presencia de un grupo
acetilénico, que se llegará a combinar con el grupo amino.
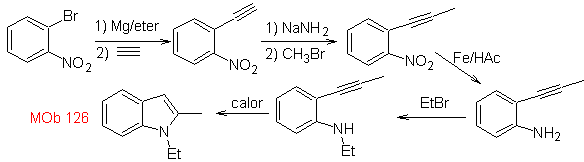
Síntesis. Para
introducir el grupo acetileno en el benceno, se hace reaccionar un
organomagnésico, con el acetileno. La
ciclación se produce por una reacción del grupo amino con el triple enlace. Las
reacciones que siguen permiten formar
Síntesis de HEGEDUS:
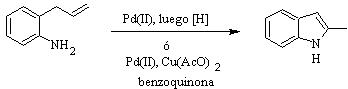
Síntesis de FUKUYAMA:
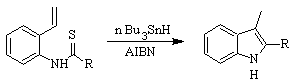
Síntesis de SUGASAWA:
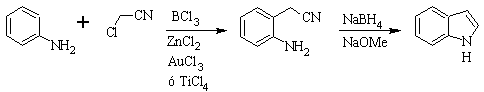
Síntesis de GASSMAN:
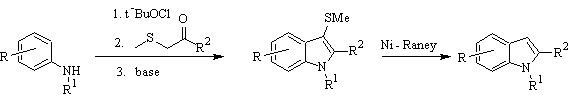
Síntesis de BARTOLI:
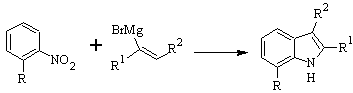
Síntesis de DOBBS:
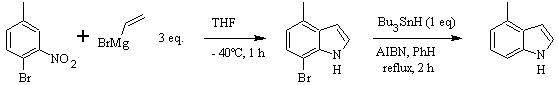
Síntesis de CASTRO:
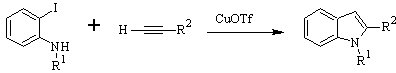
Síntesis de LAROCK:
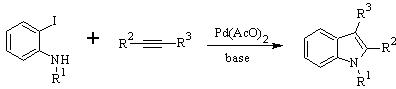
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?