Oxidación de Baeyer–Villiger
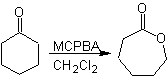
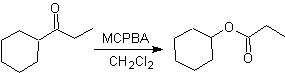
Otra reacción que puede asociarse a la estrategia de la retrosíntesis, es la oxidación de cetonas por
peroxiácidos, mas conocida como reacción de Baeyer-Villiger. En cetonas
cíclicas, la oxidación con perácidos, genera lactonas. Los grupos unidos a las
cetonas asimétricas, poseen una aptitud migratoria, que permite, en términos
literales, “ insertar un átomo de oxigeno” entre el grupo carbonilo y el grupo
migrante, produciéndose así, un éster o una lactona.
Se debe tomar en cuenta, que las enonas (cetonas α, β
insaturadas) no son buenos sustratos para la oxidación de Baeyer-Villiger, en
razón a que el alqueno es mucho mas reactivo que la cetona. Sin embargo hay estructuras especiales donde el alqueno
puede ser protegido por un sustituyente cercano por el efecto estérico y
orientarse de este modo el ataque del peracido hacia el grupo carbonilo.
|
|
… |
|
Recuérdese que la aptitud migratoria de los diferentes
grupos, en la reacción de Baeyer-Villiger, es como sigue:
H > Ph
> alquilo 3º > cicloalquilo
> alquilo 2º > alquilo 1º > Me
Proponer un plan de síntesis para las siguientes moléculas:
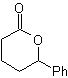
|
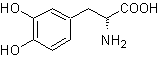
MOb 56
L-Dopa |
. |
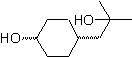
MOb 57
|
. |
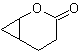
MOb 58
|
|
|
|
|
|
|
|
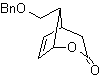
MOb 59
|
|
MOb 60
|
|
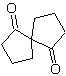
MOb 61
|
MOb 56. Análisis retrosintético.
El alfa aminoácido, de
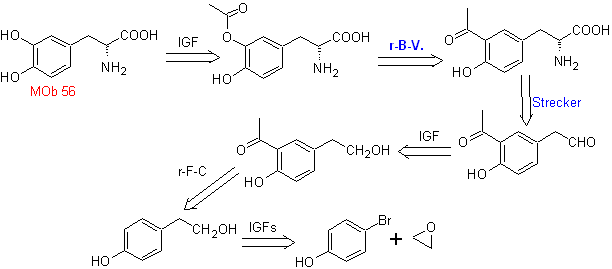
Síntesis.
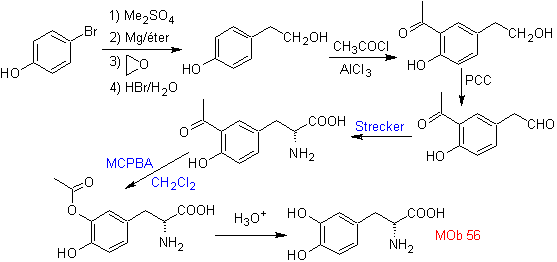
Para la formación del Grignard
requerido, se protege el OH orto del benceno. La síntesis de Strecker, permite
formar el alfa aminoácido, que es oxidado de acuerdo a Baeyer-Villiger con un
perácido y el producto se somete a una hidrólisis ácida del grupo éster, lo que
conduce a la formación de
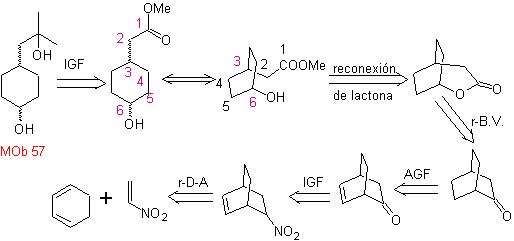
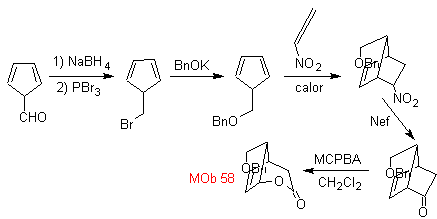
Síntesis. Se
parte de la reacción de Diels-Alder de un ciclohexadieno y un nitroetileno. El
aducto formado se satura, para proceder a la oxidación de Baeyer-Villiger. La
apertura de la lactona y esterificación del grupo ácido, forma un intermediario
que luego es tratado
con un exceso
de bromuro de metilmagnesio, para obtener
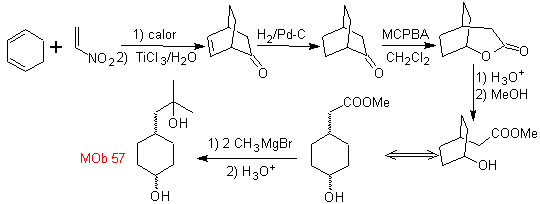
MOb
58. Análisis
retrosintético. El doble enlace conjugado con un grupo C=O, presente en
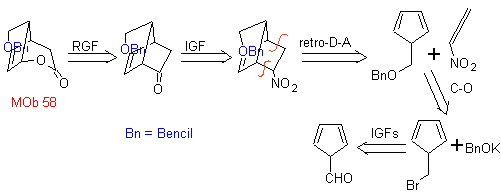
MOb
59. Análisis
retrosintético. Se procede a desconectar
Nuevamente se genera un intermedio o precursor 1,3- diCO, que al ser
desconectado, genera una nueva estructura 1,6-diCO, que ahora es posible
reconectarla para llegar al ciclohexeno como material de partida.
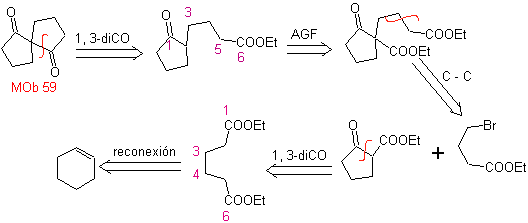
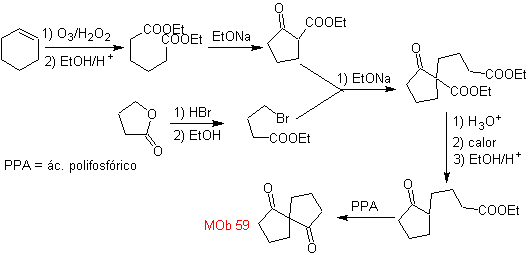
Síntesis. La apertura oxidativa de un ciclohexeno,
permite obtener la molécula precursora que luego de reaccionar con el
γ-bromoéster, origina una molécula que luego de una reacción de Dieckmann fácilmente
se transforma, en
MOb
60. Análisis
retrosintético.
Se supone, que la formación de
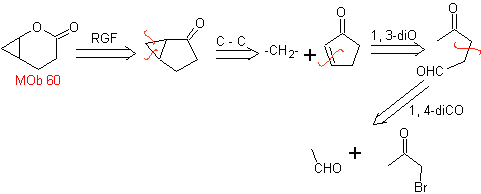
Síntesis. El enolato del acetaldehído se combina
con α-bromocetona, para formar una molécula 1,4-diCO, que en medio básico y
EtOH, se condensa con deshidratación para formar una ciclopentanona con insaturación
α,β. Se continúa con la reacción de Simonns-Schmidt, para formar el ciclopropano y una posterior
oxidación de ésta según Baeyer- Villiger produce
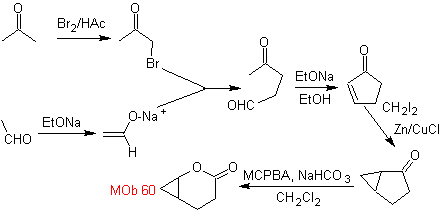
MOb
61. Análisis
retrosintético. Se asume que
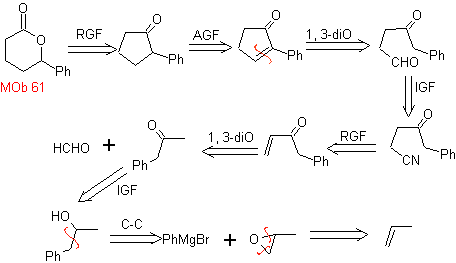
Síntesis. Se toma el propeno y benceno como
materiales de partida, la estrategia pasa por reducir el nitrilo a CHO con
DIBAL en hexano, para formar el intermedio que por anillación (o anelación) de
Robinson y posterior saturación, proporcione la ciclopentanona adecuada para
oxidarla por el procedimiento de Baeyer-Villiger, para formar
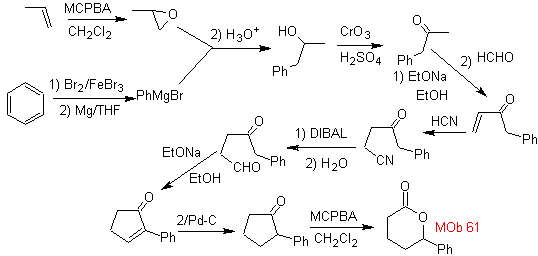
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?