Desconexión de compuestos 1,2-dioxigenados
Las desconexiones estudiadas hasta el momento, han conducido a la formación de sintones lógicos, consistentes en cationes o aniones, cuyas cargas han estado estabilizadas por grupos funcionales o estructuras totalmente claras. Lamentablemente ello no siempre es así. Existe un conjunto bastante significativo de moléculas orgánicas que presentan desconexiones muy específicas, por lo que es difícil encontrar un modelo de desconexión general, razón por la cual se las estudia individualmente.
1.- Compuestos a-hidroxicarbonílicos
Los compuestos α-hidroxicarbonílicos se desconectan en el enlace C-C que une a las dos funciones. Esta operación conduce a un sintón natural o lógico (el sintón catiónico) y a un sintón no natural o ilógico (el sintón aniónico). Los equivalentes sintéticos pueden ser aldehídos e ión acetiluro respectivamente.
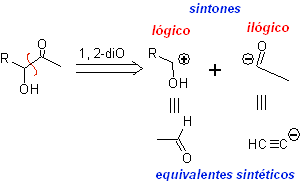
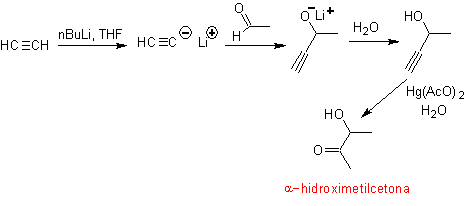
El grupo acetileno terminal con sales mercúricas en medio acido forma una metilcetona. Esta reacción es también útil si el grupo acetileno es interno y además simétrico.
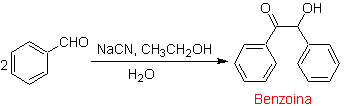
Un caso especial de α-hidroxicetonas son las benzoínas o diarilhidroxicetonas, en donde los dos grupos R son aromáticos o heterociclos. Las benzoínas son resultado de la autocondensación del benzaldehído catalizada por iones cianuro.
Las benzoínas pueden no ser simétricas, por ejemplo uno de los aldehídos, puede ser un aldehído piridínico. El ión cianuro no cataliza a los aldehídos alifáticos, los cuales sufren el mismo acoplamiento en presencia de sales de tiazolio.
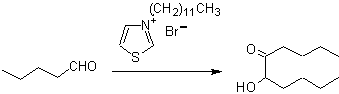
Las α-hidroxicetonas alifáticas, pueden formarse a partir de la condensación de esteres carboxílicos con sodio metálico en un solvente inerte y bajo reflujo. Estas hidroxicetonas se denominan aciloínas y las reacciones de condensación pueden formarse de manera intramolecular e intermolecular.
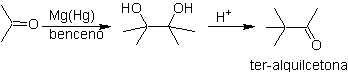
La reducción bimolecular de cetonas a pinacoles, es una de las pocas reacciones radicalarias de utilidad sintética, debido a la aptitud de estos pinacoles de participar de reacciones de transposición, denominada transposición pinacolínica para producir ter-alquilcetonas.
Los compuestos reunidos bajo la denominación de ácidos oxocarboxílicos que comprenden los aldehidoácidos y los cetoácidos, tienen una gran importancia en la serie alifática y tanto por su relación bioquímica con los oxácidos, como por las reacciones de síntesis que pueden producirse a partir de ellos o de sus derivados, constituyen un importante grupo de compuestos orgánicos, sobre los cuales se están trabajando intensamente en los últimos tiempos. Los ácidos α-hidroxicarboxilicos, cuando son desconectados, también generan un sintón ilógico, como el ión cianuro. El grupo ciano o nitrilo, por hidrólisis básica, seguida de neutralización, genera el grupo carboxílico de los ácidos.
2.- Compuestos 1,2-Dioles.
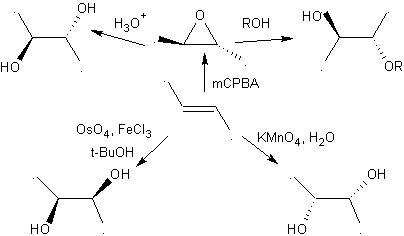
Los 1,2-dioles, tienen en las olefinas los mejores precursores para su preparación, sólo dependerá de la estereoquímica del diol en cuestión, para recurrir a una de las reacciones especificas resumidas en el cuadro adjunto.
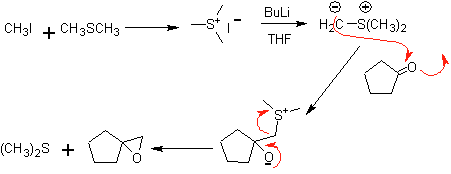
En realidad los epóxidos también permiten obtener otros compuestos 1,2 dioxigenados, cuando es abierto por un nucleófilo como los alcóxidos por ejemplo. Los aldehídos y cetonas, también sirven como moléculas precursoras para preparar los epóxidos, cuando son tratados con iluros de azufre.
3.- Electrófilos “ilógicos”
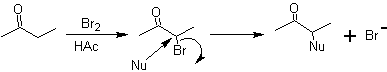
Las moléculas 1,2-dioxigenadas, también pueden construirse empleando electrófilos ilógicos; los reactivos mas importantes de este tipo son los compuestos carbonílicos alfa-halogenados obtenidos por halogenación de la forma enólica de un compuesto carbonílico. La halogenación de cetonas, permite obtener compuestos 1,2 difuncionalizados, debido a que el halógeno es un buen grupo saliente y puede sustituirse fácilmente con otros nucleófilos. El mecanismo de reacción implica la formación de un enol termodinámico.
Sin embargo, la halogenación de aldehídos y ácidos no resulta tan simple, debido a los bajos rendimientos, por lo que se han ideado alternativas de halogenación muy interesantes. Otro método para obtener α-hidroxiácidos, consiste en la hidrólisis de α-haloácidos (reacción de Hell-Volhard-Zelinsky)
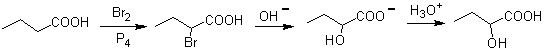
4.- Compuestos 1,2 difuncionalizados por reconexiones.
Otro método que produce compuestos 1,2 difuncionalizados consiste en la ruptura oxidativa de enlaces dobles por el ozono para generar dos carbonilos, que variarán de acuerdo a las condiciones de reacción. Así, la ozonólisis, seguida de un tratamiento con: dimetilsulfuro (Me2S) genera aldehídos, peróxidos de hidrogeno produce ácidos y borohidruro de sodio, para formar alcoholes. La estrategia, consiste en la reconexión de los carbonos oxigenados (alcoholes, aldehídos, cetonas o ácidos), en las relaciones de distancia, 1,2 diO, para formar el correspondiente alqueno del cual se supone derivaron por la reacción de ozonólisis.
| Proponer un diseño de síntesis para las siguientes moléculas : |
MOb 48:
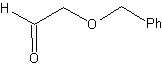
|
|
|
Análisis retrosintético. La MOb 48 es un éter olefínico no simétrico y con el grupo aldehído en un extremo, razón por la cual, se puede asumir que el mismo es resultado de la apertura de un doble enlace por ozonólisis seguido de la reacción con Me2S. El doble enlace del precursor se funcionaliza a un alquino interno etéreo simétrico.
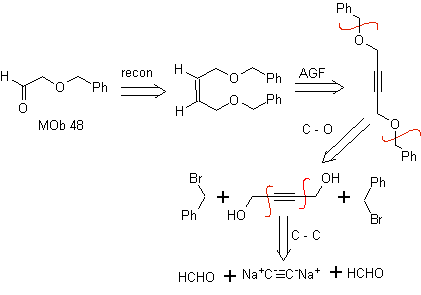
Los éteres son resultado de la aplicación de la síntesis de Williamson y el diol de la reacción del diacetiluro sobre aldehídos, como material de partida.
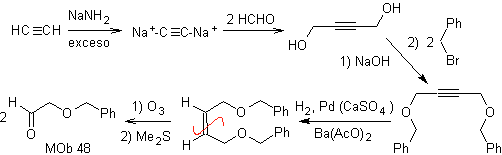
Síntesis. El diacetiluro se consigue con un exceso de sodamida, que actúa son formaldehído, para dar el alcohol, que se eterifica por Williamson. El alquino se reduce a alqueno que es abierto por Ozonólisis, seguido de reacción con Me2S para formar el aldehído.



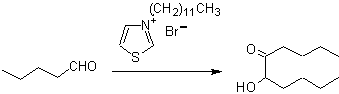
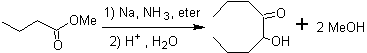
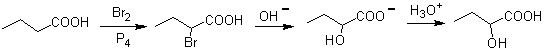


 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?







