SÍNTESIS DE HETEROCICLOS POR CICLACIÓN INTRAMOLECULAR
La construcción de sistemas heterocíclicos también utiliza estas mismas
reacciones, con la particularidad de que en el sistema heterocíclico debe estar
presente o contener al menos un átomo diferente al carbono. Los más comunes son
el nitrógeno, oxigeno, azufre y fósforo.
El sistema cíclico de la molécula que se desea sintetizar, puede
provenir de la modificación de un sistema cíclico presente en alguno de los
reactivos implicados en la síntesis o ser el resultado de la ciclación de
antecedentes no cíclicos y que ha sido construido en el desarrollo de la
síntesis por ciclación intramolecular o por métodos basados en ciclaciones
intermoleculares (cicloadiciones).
1. Ciclación intramolecular
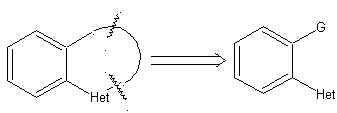
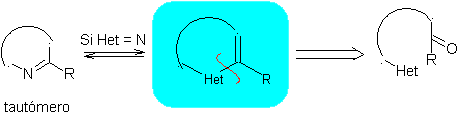
Las reglas generales de desconexión de heterociclos provenientes de una
ciclación intramolecular, fueron adecuadamente sistematizadas por J. I. Borrell[1],
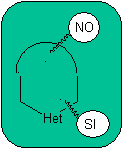
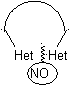
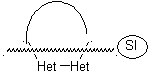
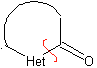
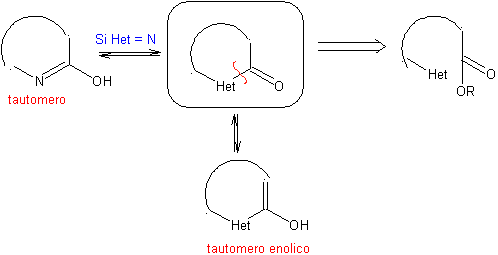
las mismas que se asumen en la presente sección (Het = N, O, S)
1.
En la síntesis de un compuesto monociclico, el cierre del
anillo supone generalmente la formación de un enlace carbono- heteroátomo.
|
Modelo:
|
|
|
Ejemplo: |
|
|
|
|
|
|
Ejemplo:
|
|
|
Modelo:
|
|
|
Ejemplo:
|
|
[1] BORRELL J.I. “Introducción
al Análisis Retrosintético”. Cap. 8.Laboratori de Sintesi. Grup
d’Enginyería Molecular (GEM). Institut Químic de Sarriá, Universitat Ramon
Llull. España. (Diapositivas de apoyo para Clases)
1.1.
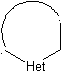
Modelos para la ciclación intramolecular
Se pueden mencionar tres modelos para la ciclación intramolecular y las
correspondientes desconexiones:
|
Modelo saturado:
|
|
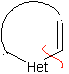
Modelo α-insaturado
|
|
Modelo α-carbonilo
|
1.1.1.
Modelo
saturado
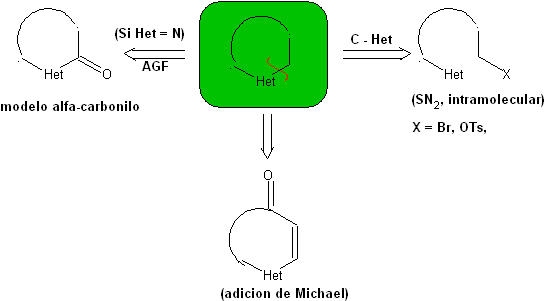
Proponer un
diseño de síntesis, a partir de materiales simples y asequibles, para las
siguientes moléculas:
|
MOb 65
|
… |
MOb 66
|
… |
MOb 67
|
Síntesis. Se inicia con la acilación de Friedel
– Crafts del benceno por un lado y por el otro con la bromación del, acetato de
etilo, según H. V. Z. Las siguientes etapas, requieren de un trabajo en medio
básico y al final se procede a la hidrogenación de los centros insaturados para
llegar a
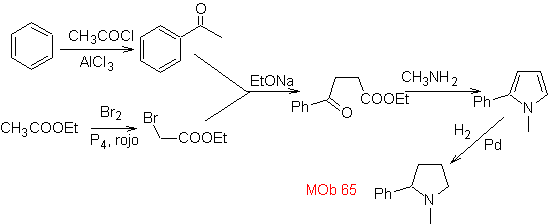
MOb.
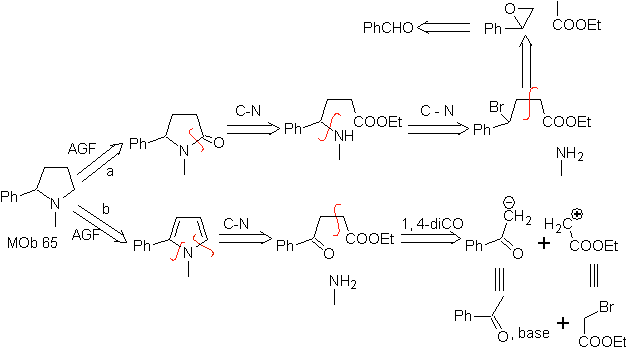
66. Análisis
retrosintético.
El ataque del N nucleofílico al carbono β, en relación al grupo éster, (MOb 66)
es orientador para pensar que el mismo se formó por una adición intramolecular
conjugada de Michael, de una amina sobre un éster α, β insaturado. La
desconexión C- N, da origen a otras desconexiones comunes, hasta llegar a
materiales de partida simples.
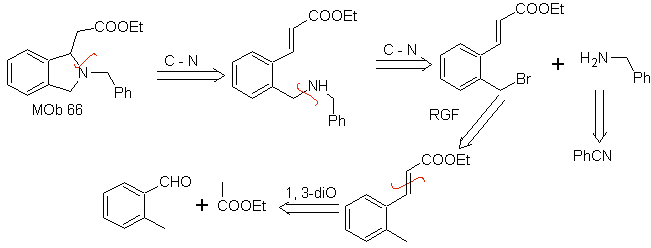
Síntesis. El o- metil
benzaldehído, puede prepararse, de ser necesario, por la reacción de
Gattermann–Koch, sobre el ácido para-metil sulfónico. El resto de reacciones,
para la síntesis de
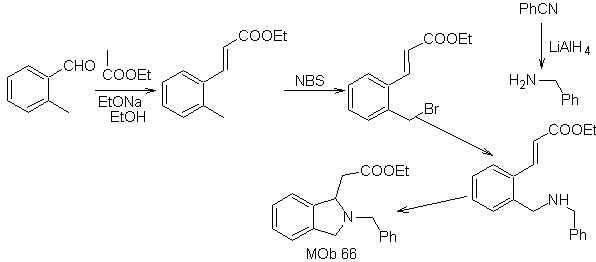
MOb
67. Análisis
retrosintético.
Al igual que en el ejemplo anterior, el enlace C-O en la posición β al grupo
éster, en
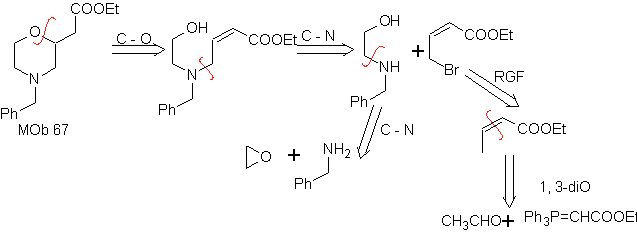
Síntesis. La
síntesis de
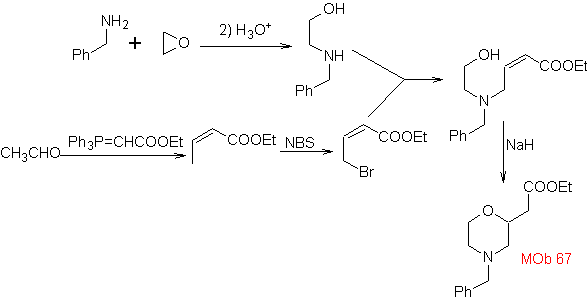
1.1.2.
Modelo
α-insaturado
Proponer un diseño de síntesis a partir de materiales simples y asequibles,
para las siguientes moléculas:
|
MOb:
68
|
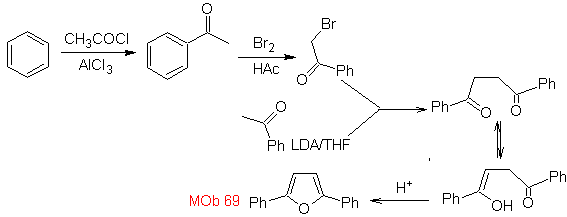
MOb: 69
|
MOb: 70
|
MOb: 71
|
MOb
68. Análisis
retrosintético.
El proceso de desconexión de
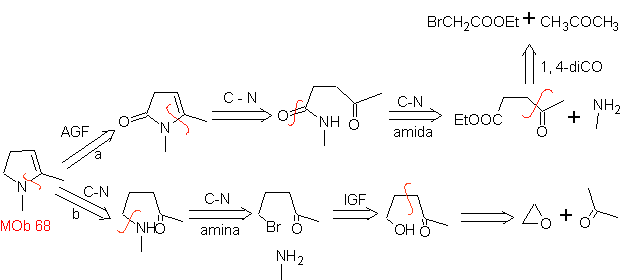
Síntesis. Las vías de desconexión, de
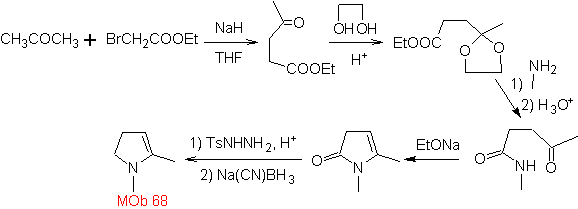
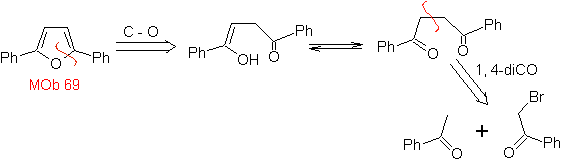
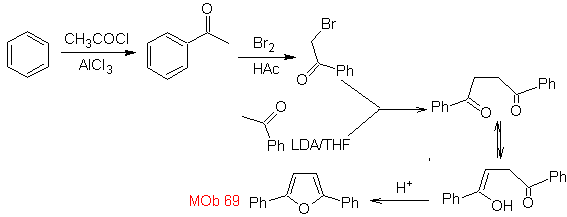
MOb.
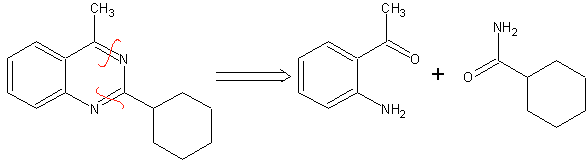
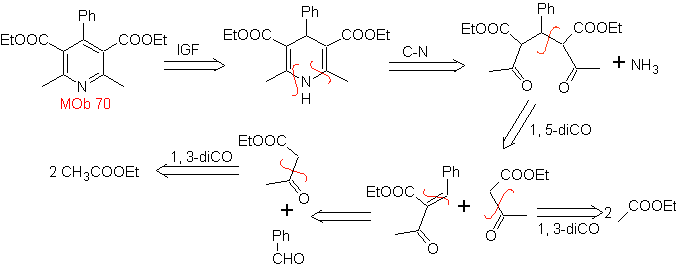
70. Análisis
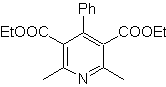
retrosintético. Esta MOb es un derivado piridínico, la
estructura que presenta es característica de los productos formados en la síntesis
de piridinas de Hansch, es decir, se deberá formar el ciclo piridínico a partir
de una aldehído y dos moles de compuesto 1,3- diCO y oxidar la dihidroquinona
intermedia formada.
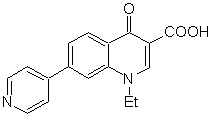
MOb
71. Análisis
retrosintético.
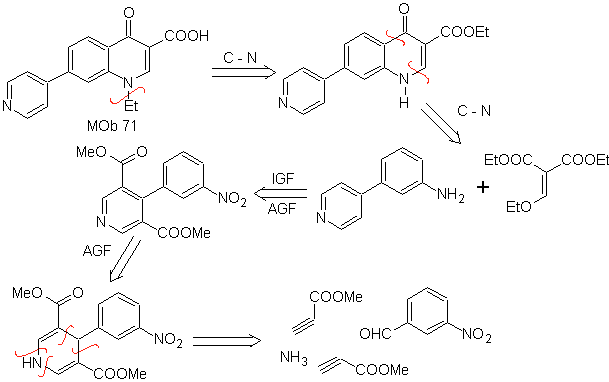
La desconexión simultánea, sobre la cetona y la amina, muestran a la
anilina y el compuesto carbonílico que se condensaron. Como es poco probable la
introducción del anillo bencénico en una piridina, se toma la estrategia de
construir el anillo piridínico a partir de derivados acetiluros apropiados.
Síntesis. Los ésteres
nitrílicos, conjuntamente el m-nitrobenzaldehido, permiten la ciclación
intermolecular, para formar un derivado hidropiridínico que se oxida a piridina
con HNO3 conc.
Luego el grupo nitro, permite
construir el anillo piridínico de la quinoleina, por reacciones de condensación
con un compuesto diCO adecuado. La etilación

Proponer un plan de síntesis, a partir de materiales simples, para las
siguientes moléculas:
|
MOb: 72
|
|
MOb: 73
|
|
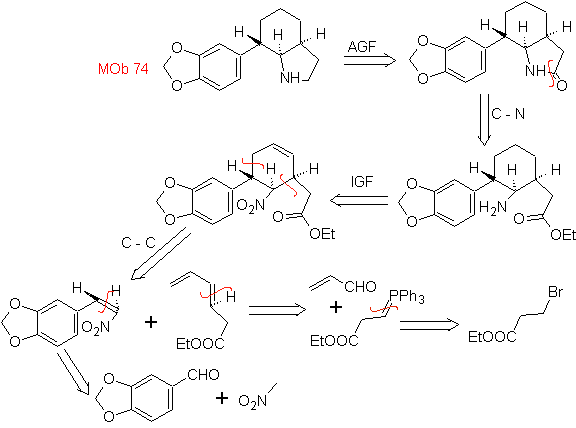
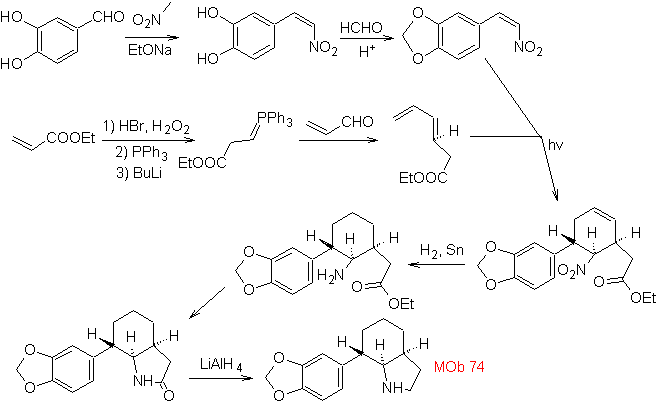
MOb: 74
|
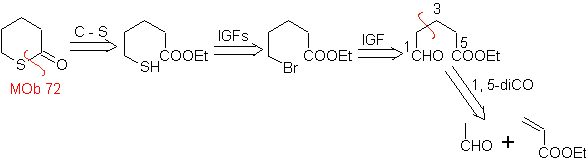
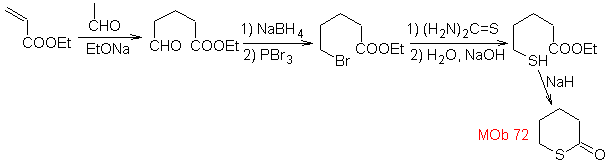
MOb
72. Análisis
retrosintético. Esta MOb es
una tetrahidropiranona, se desconecta por el enlace S-CO. Las siguientes IGFs,
permiten formar un precursor 1,5-diCO, que desconectado, proporciona los
materiales de partida
MOb
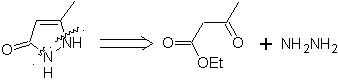
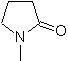
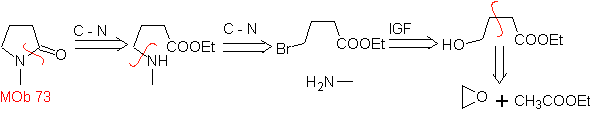
73. Análisis
retrosintético. La desconexión del enlace amido de la lactama, genera
la primera molécula precursora que es un γ. aminoéster, que se forma entre una
amina primaria y el γ-bromoéster y
consiguientemente el γ-hidroxiéster, que se reacciona entre el enolato del
acetato de etilo y un epóxido como materiales de partida simples y asequibles.
Síntesis: El epóxido y acetato de etilo son los reactivos que reaccionan para
formar el γ-hidroéster. El
OH se sustituye por bromo con PBr3 y ésta reacciona con metilamina. para, formar
la molécula precursora que se cierra en un anillo lactámico, para formar
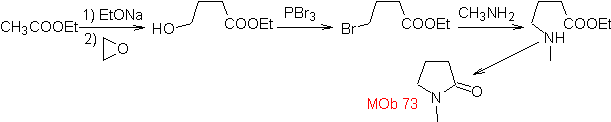
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?