DESCONEXIÓN DE COMPUESTOS 1,6-DIOXIGENADOS
Los compuestos 1,6 difuncionalizados, preferentemente utilizan la estrategia de la reconexión para su respectiva síntesis; esta estrategia, puede muy bien combinarse con la reacción de Diels-Alder, que en general forma como producto, aductos olefínicos de seis eslabones o la reducción de Birch de anillos bencénicos, que igualmente genera productos olefínicos de seis eslabones
1. Compuestos 1,6 dioxigenados
La reacción que genera compuestos dicarbonílicos, de diferente combinación posible: dicetonas, cetoácidos, cetoaldehidos, diácidos, etc y a diferentes distancia la una de la otra, sin duda, es la reacción de ozonólisis de compuestos olefínicos.
Dependiendo de la estructura del sustrato y las condiciones de la reacción sobre el ozónido intermedio formado, se conseguirán una diversidad enorme de compuestos como resultado de la ruptura del doble enlace olefínico. De ellos, son de especial interés aquellos que se hallan en una relación 1, 6 – dioxigenada, como puede colegirse de la siguiente operación sintética de “reconexión”:
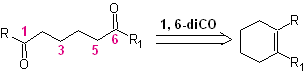
La mejor manera de comprender el funcionamiento de esta “operación sintética de reconexión”, se lo conseguirá a través de la solución de la síntesis de las siguientes moléculas orgánicas:
|
MOb 50
|
|
MOb 51
|
|
MOb 52
|
|
|
|
|
|
|
|
MOb 53
|
|
MOb 54
|
|
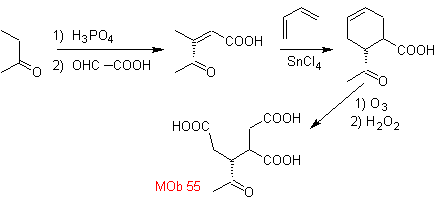
MOb 55
|
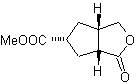
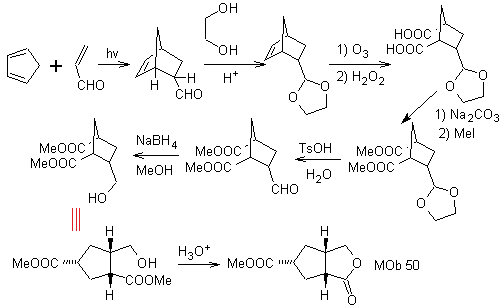
MOb 50. Análisis retrosintético: En primera instancia se desconecta por la función lactona de la molécula. Sobre la molécula precursora generada, a su vez, se puede plantear que su formación puedo haber ocurrido a partir del diácido carboxílico en posición 1-6. Los cuales se reconectan para dar origen al alqueno que los produjo por reacción de ozonólisis oxidativa. El alqueno formado es un típico aducto de de Diels –Alder, entre el ciclopentadieno y el crotonaldehido
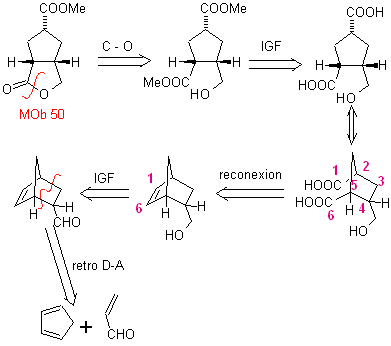
Síntesis: La reacción de Diels-Alder entre el ciplopentadieno y el aldehído α,β-insaturado, proporciona el aducto alqueno, para su correspondiente apertura por ozonólisis oxidativa, previa una reacción de protección del grupo aldehído, que posteriormente se desprotege, para ser reducido a la función alcohol. Este alcohol, reacción con el grupo éster en medio ácido, para formar la lactona deseada, MOb 50
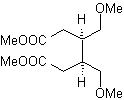
MOb 51, Análisis retrosintético: Se proyecta la molécula precursora de
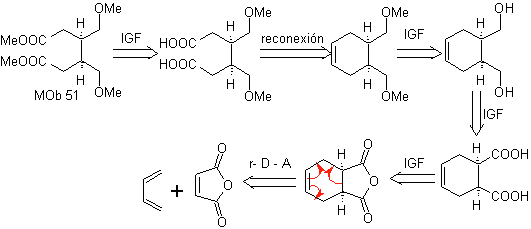
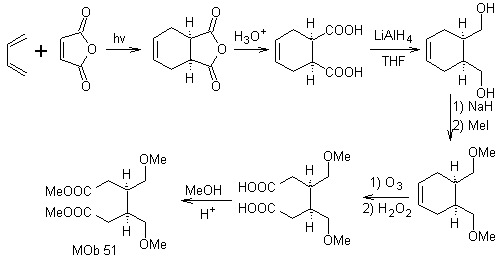
Síntesis. Con la reacción de Diels-Alder, se forma el aducto anhídrido cíclico, que luego de ser hidrolizado es reducido al respectivo alcohol, que por Williamson se transforman en éteres. El ciclohexeno se abre por ozonólisis oxidativa y los grupo ácidos reaccionan en medio ácido con el alcohol metílico para transformarse en
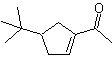
MOb 52. Análisis retrosintético: Inicialmente se desconecta
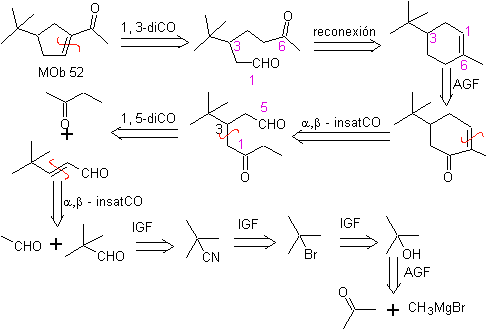
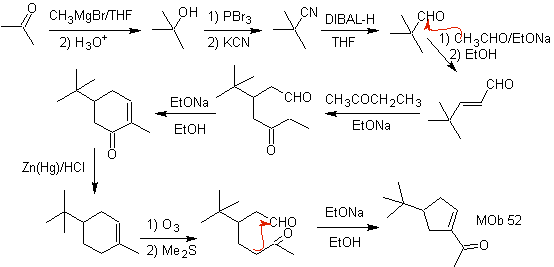
Síntesis: La acetona, permite formar el intermediario t-Butilformaldehido, que en medio básico y etanol, se condensa con el etanal. Al producto, α, β-insat CO formado, se adiciona el enolato de la butanona, el mismo medio básico permite la ciclación intramolecular. Luego el C=O se transforma en –CH2, por reducción. El cicloalqueno producido se abre por ozonólisis en Me2S. Y nuevamente se cicla en medio básico para obtener
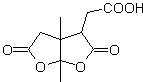
MOb 53. Análisis retrosintético: Se empieza por la desconexión simultánea de las lactonas de
Por otro lado, la butanona se prepara a partir de un acetileno terminal y éste último a partir de un haluro de etilo y acetiluro sódico.
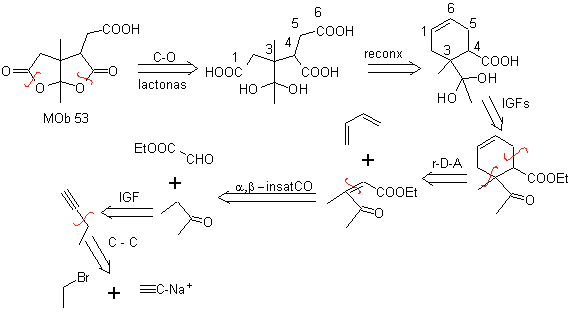
Síntesis. Luego de la apertura del ciclohexeno, por ozonólisis oxidativa, La hidrólisis ácida del grupo éster que queda y la correspondiente formación del hidrato cetónico, es suficiente para la formación de las lactonas y el respectivo cierre del ciclo, para producir
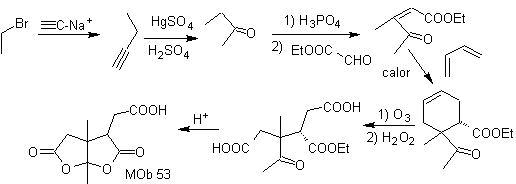
MOb 54. Análisis retrosintético: La desconexión por el doble enlace de
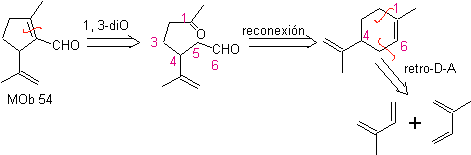
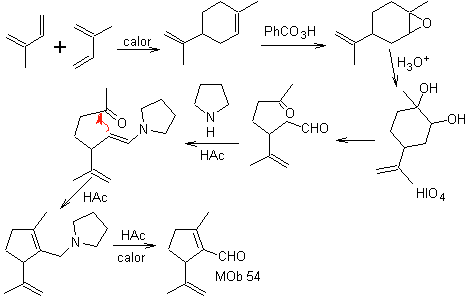
Síntesis: La reacción de Diels-Alder entre dos moléculas de 2-metil butadieno, forma un aducto que con HMCPBA forma un epóxido con el centro más reactivo.
· Por hidrólisis ácida del epóxido se forma un diol que es oxidado por ácido. periódico, hacia un compuesto 1,6-diCO Se protege el grupo CHO con una enamina, al mismo tiempo de activar su C alfa, para una condensación en medio ácido, se calienta el sistema y se obtiene
MOb 55. Análisis retrosintético: La síntesis de
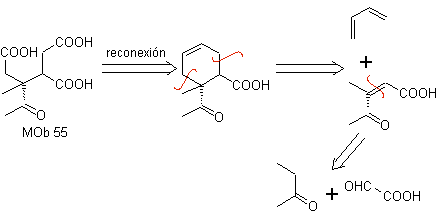
Síntesis. Las reacciones que se indican ya fueron estudiadas, en la síntesis de
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?