Síntesis de compuestos 1,3 y 1,5-dicarbonílicos
Proponer un diseño de síntesis por el método de las desconexiones (método del sintón) a partir de materiales simples y asequibles, para las siguientes moléculas:
(Recuerde que si no es posible plantear una desconexión directa, será necesario recurrir a la estrategia de funcionalizar previamente la MOb, hasta llegar a un modelo de desconexión aplicable)
SOLUCIONES A LOS PROBLEMAS PROPUESTOS
La MOb 01, no presenta ninguna relación dioxigenada, aspecto que en algún sentido es una ventaja para el químico. Esto es, la estrategia a utilizarse, permitirá buscar relaciones dioxigenadas en la molécula precursora (equivalente sintético) con cierto grado de libertad, es decir, puede postularse según la estructura de la MOb, una gama de relaciones dicarbonílicas y/ó hidroxicarbonílicas, en posiciones relativas 1,2, 1,3, 1,4, 1,5 y/o 1,6 o sus variantes, como son los compuestos α, β-insaturado carbonílicos.
En esta oportunidad, se ejercitará las síntesis, recurriendo a las relaciones 1,3 y/o 1,5 dioxigenadas. De este modo se convertirá a la molécula objetivo y precursoras en estructuras desconectable según un modelo conocido y preestablecido.
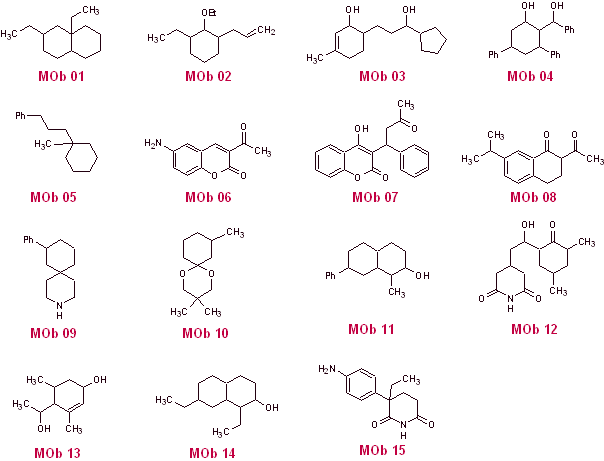
Solución MOb 01
Análisis retrosintético: En la molécula que nos ocupa, se puede empezar por realizar un AGF, colocando un grupo C=O en la estructura de la molécula precursora, en posición tal, que permita luego realizar otro AGF, con un doble enlace ubicado en el carbono alfa y beta respecto al carbonilo, para proceder a desconectarlo.
La insaturación α, β, respecto del C=O, debe buscarse como el alqueno más sustituido de las alternativas que podrían existir. La presencia de un sustituyente en la posición beta al C=O, induce a pensar que el mismo pudo adicionarse como nucleófilo a un compuesto α, β insaturado carbonílico, según la reacción de adición conjugada de Michael. En base a estas consideraciones, puede postularse el siguiente análisis retrosintético, para la MOb 01:
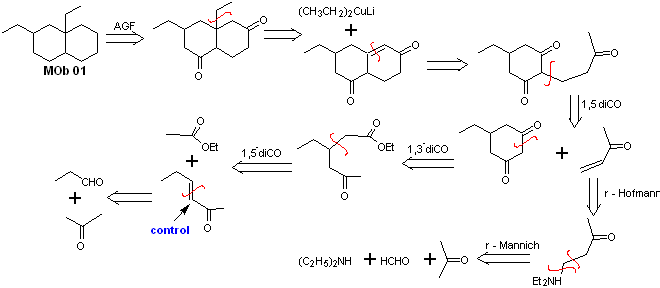
Síntesis de la MOb 01: La condensación entre un aldehído y cetona enolizables, normalmente origina productos de autocondensación o de condensación cruzada. Esto se puede evitar, recurriendo a la estrategia de ejercer control, en el nucleófilo de la cetona, como puede verse en el esquema adjunto.
Por otro lado, cuando se requiere utilizar cetonas vinílicas como sustrato en la reacción de Michael, supondría la utilización del formaldehído. Lamentablemente este aldehído al ser muy reactivo en medio básico, tiende a originar reacciones de polimerización, que bajan drásticamente el rendimiento de la síntesis, por tal razón se combina adecuadamente las reacción de Mannich y la eliminación de Hofmann, para las cetonas vinílicas con rendimientos altos.
La eliminación de Hofmann, podría llevarse acabo en el mismo medio básico que se utiliza para la reacción de Michael, por lo que no es necesario aislar la vinilcetona.
Sin embargo, debido a la experiencia aún limitada en síntesis, se postulará la utilización de un óxido de plata en medio acuoso para lograr la eliminación de la amina y formación de la vinilcetona
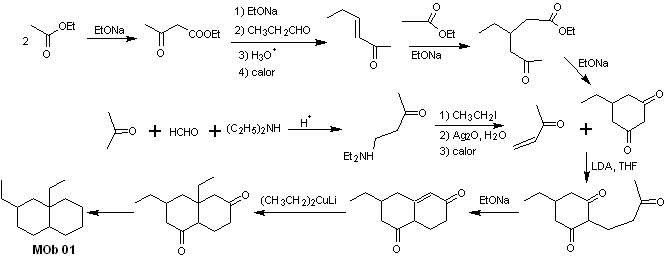
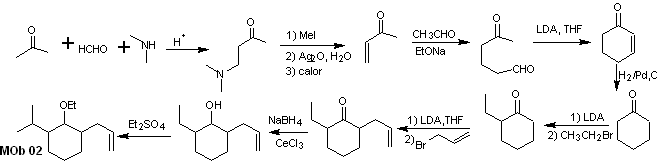
Solución MOb 02
Análisis retrosintético: La presencia de los grupos etilo y propenilo en posición 2 al grupo éter, orienta la estrategia de desconexión por funcionalizar el éter hasta la cetona, y posteriormente ocuparse de la alquilación de un enolato de la ciclohexanona. Las desconexiones que se producen en las moléculas precursoras, han sido explicadas en la solución de la MOb 01.
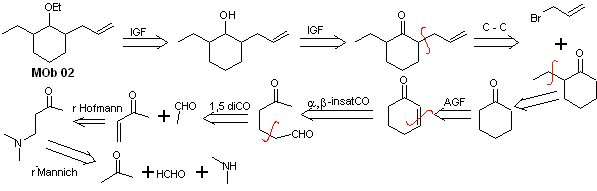
Síntesis. Para preparar el enolato cinético, se recurrirá a la utilización del LDA, en razón a que esta base, débilmente nucleófila presenta un alto impedimento estérico y abstrae un protón del carbono menos impedido de la cetona. Por otro lado, para garantizar la reducción del grupo carbonilo a alcohol en presencia de un grupo alqueno, se utilizará el NaBH4 en presencia de sales de Ce+3.
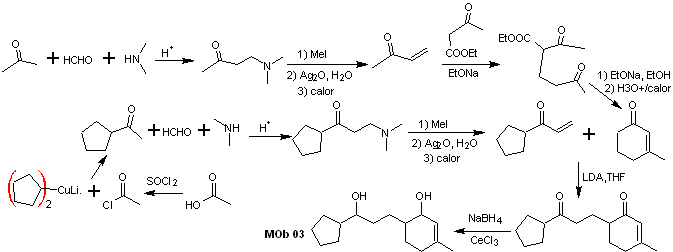
Solución MOb 03
Análisis retrosintético: La posición relativa en 1,5 de los grupos hidroxilo, permite proponer una molécula precursora 1,5-diCO, la cual se desconecta según este modelo por el enlace que une la ciclohexenona al resto de la molécula, para formar dos moléculas precursoras α, β-insaturado CO.
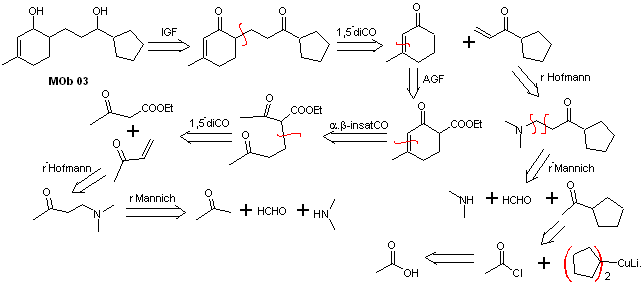
Síntesis. Es necesario ejercer control para la formación de las cetonas vinílicas, para lo cual se combinan adecuadamente la reacción de Mannich, seguida de la eliminación de Hofmann. Para la reacción de Michael se puede hacer uso como nucleófilo un cetoéster formado por condensación de Claisen del éster acetato de etilo, de este modo se evita la autocondensación de la cetona.
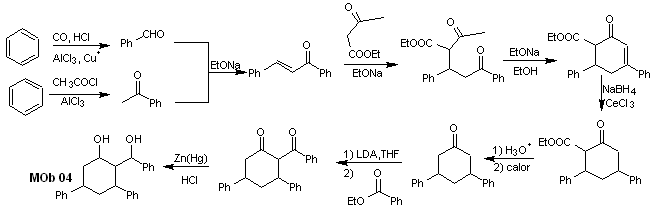
Solución MOb 04
Análisis retrosintético: Los OH en posición 1,3, pueden transformarse a 1,3-diCO, para proceder a la desconexión según este modelo, lo que origina dos equivalentes sintéticos, de los cuales se somete a funcionalizar por adición del –COOEt y un punto de insaturación en la 3,5-difenilciclohexanona. Los precursores generados, presentan modelos dioxigenados para su respectiva desconexión.
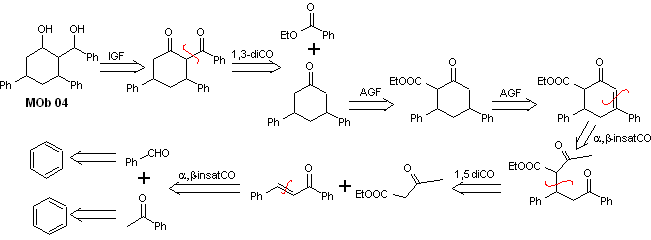 Síntesis. Se parte del benceno y ejerce
control en la reacción de Michael y las condensaciones.
Síntesis. Se parte del benceno y ejerce
control en la reacción de Michael y las condensaciones.
Solución MOb 05
Análisis retrosintético: Puede plantearse relaciones dicarbonílicas diversas para la estructura de la molécula precursora (equivalente sintético) de la MOb 05. Por ejemplo, ubicando el primer grupo C=O unido al benceno, pueden postularse una relación 1,3-diCO, un α, β-insatCO o 1,5-diCO, que involucra al ciclohexano, con uno o dos grupos C=O. Se asume esta última opción, debido a que existe un grupo metilo adicional entre los grupos C=O, lo cual es fácil de preparar, debido precisamente al efecto activador de los dos grupos C=O, en el nucleófilo que se forma en medio básico. En base a estas consideraciones puede postularse el siguiente esquema de análisis retrosintético para la MOb 05.
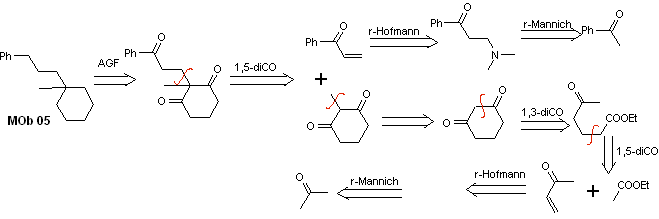 Síntesis. La
acetofenona vinílica, se prepara con buenos rendimientos a través de la
reacción de Mannich, seguida de la eliminación de Hofmann. Por otro lado
la 1,3-ciclohexanodiona, se prepara a
partir de la condensación de Claisen, de un cetoéster en posición 1,5-diCO. Se
alquila esta dicetona y en medio b´sico se abastrae un H, para formar el
nucleófilo que actuará sobre el compuesto a,b-insatCO. Los grupos C=O de la
molécula tricarbonílica formada, se reducen a metilo por reducción de
Clemmensen, colocando un exceso de amalgama de cinc en medio ácido.
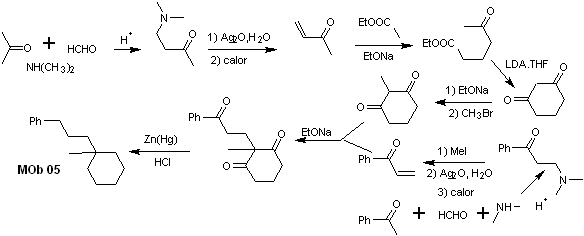
Síntesis. La
acetofenona vinílica, se prepara con buenos rendimientos a través de la
reacción de Mannich, seguida de la eliminación de Hofmann. Por otro lado
la 1,3-ciclohexanodiona, se prepara a
partir de la condensación de Claisen, de un cetoéster en posición 1,5-diCO. Se
alquila esta dicetona y en medio b´sico se abastrae un H, para formar el
nucleófilo que actuará sobre el compuesto a,b-insatCO. Los grupos C=O de la
molécula tricarbonílica formada, se reducen a metilo por reducción de
Clemmensen, colocando un exceso de amalgama de cinc en medio ácido.
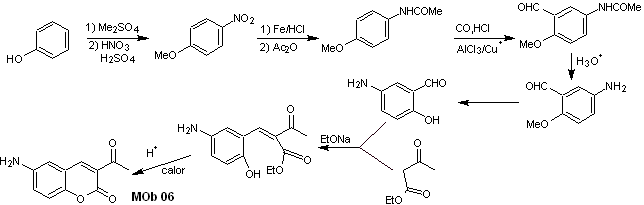
Solución MOb 06
Análisis retrosintético. Se desconecta por la lactona, operación que permite vislumbrar a un grupo éster. La molécula precursora formada, puede también ser sometido al compuesto carbonílico, que pudo haberse formado
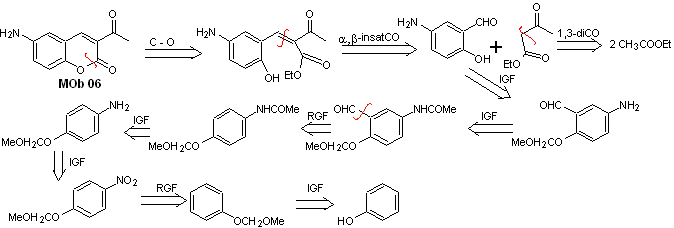
Síntesis. El grupo alcohol se controla, protegiéndolo con dimetil éter. Luego debe sintetizarse el compuesto dicarbonílico
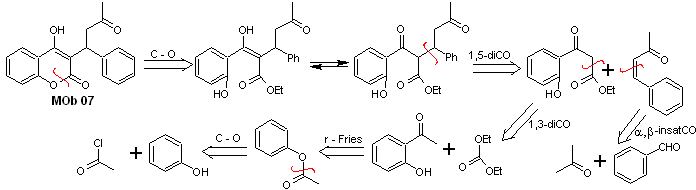
Solución MOb 07
Análisis retrosintético. Nuevamente se inicia el proceso de desconexión por la función lactona, las relaciones dioxigenadas que aparecen en la ropa de baile. Se continúa con la desconexión 1,5-diCO, y así, se arriba al fenol y al benzaldehído.
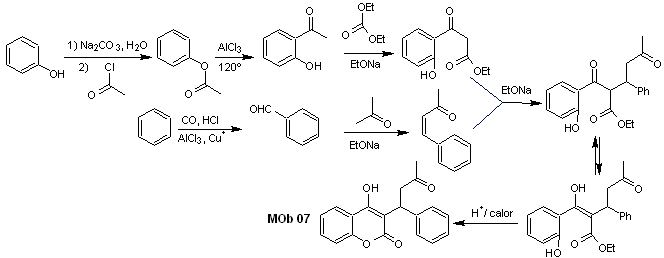
Síntesis. Los materiales de partida son el benceno y el fenol, el acetilfenol requerido, se prepara según la reacción de transposición de Fries.
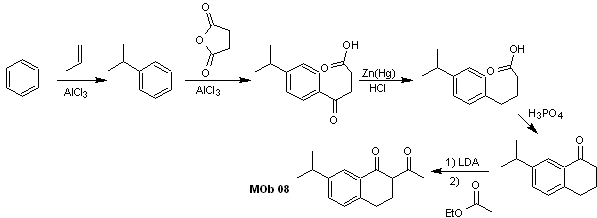
Solución MOb 08
Análisis retrosintético. La presencia de la relación 1,3-diCO en la MOb 08, invita a desconectarlo según este modelo de desconexión, la molécula precursora generada, no es necesario funcionalizarla a ningún modelo dioxigenado desconectable, sino que se aprovecha las reacciones de ciclación de la acilación intramolecular de Friedel-Crafts.
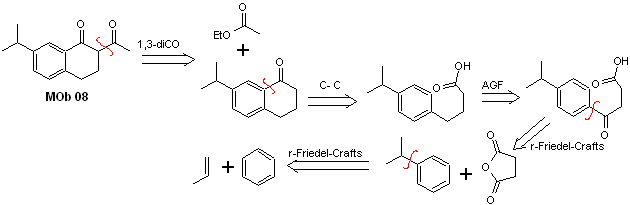
Síntesis. La acilación del cumeno con anhídrido succínico son las reacciones básicas que gobiernan la síntesis, La orientación del grupo isopropil a un segundo electrófilo que se aproxime al anillo bencénico, es la ideal, para formar la MOb.
Solución MOb 09
Análisis retrosintético: El heterociclo nitrogenado de la MOb, puede funcionalizarse hacia una estructura fácilmente desconectable como la función amida. El esqueleto 1,5-diCO producido, se desconectará según prevé este modelo, para arribar a un α, β -insatCO, que desconectado genera un equivalente sintético de una ciclohexanona sustituida con el grupo fenilo. Esta última estructura requiere del uso adecuado de la retro- Hofmann y retro-Mannich, para arribar a materiales de partida simples y asequibles.
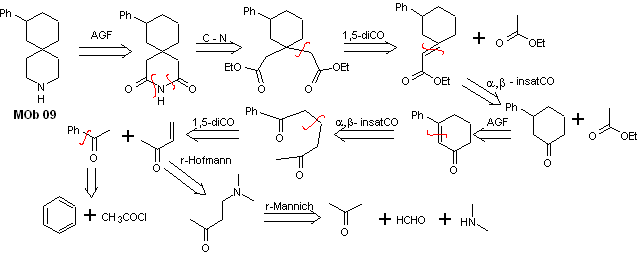
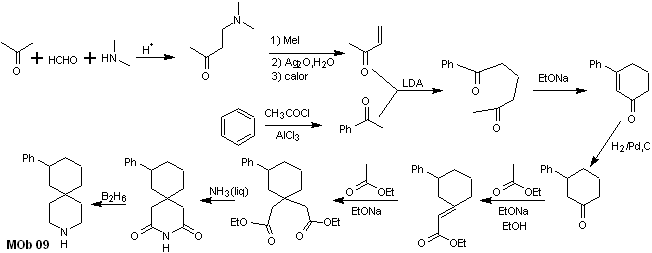
Síntesis. La combinación adecuada de la reacción de Mannich y eliminación de Hofmann, seguida de reacciones condensación del tipo aldólico y Michael, dominan la estrategia de síntesis de la MOb 09,
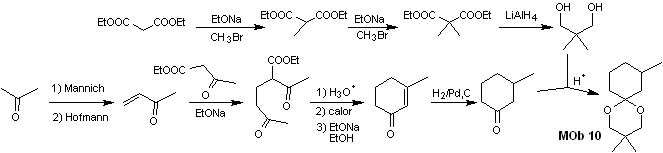
Solución MOb 10
Análisis retrosintético: La desconexión del acetal cíclico, conduce a una molécula precursora, fácilmente convertible en un modelo de desconexión conocido como es el α, β-insatCO. Las funciones dioxigenadas que se van generando posteriormente, son desconectable, por modelos conocidos.
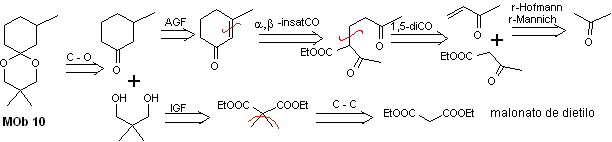
Síntesis. El malonato de dietilo es el material de partida simple requerido para la síntesis por un lado y por el otro el acetoacetato de etilo. E malonato de dietilo se metila doblemente y por reducción del mismo con exceso de LiALH4, se prepara el diol. Que en medio ácido formará el acetal cíclico.
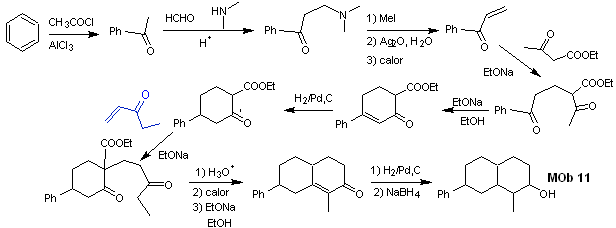
Solución MOb 11
Análisis retrosintético. La funcionalización más adecuada, requiere de la adición de dos instauraciones conjugadas con el grupo C=O, esta estrategia se verá luego justificada, cuando se requiera de un nucleófilo para adicionarse a un sustrato de Michael.
Por otro lado será necesario ejercer control, en algunas condensaciones, para evitar la autocondensación de la acetona, para ello se utiliza el éster acetoacético, resultado de la condensación de Claisen del éster acetato de etilo.
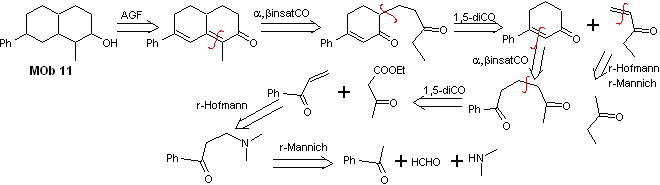 Síntesis. Las reacciones iniciales de la
síntesis, ya han sido explicadas abundantemente en la solución de las MOb
precedentes, sólo se deberá resaltar, que la reacción de condensanción
intramolecular requerida, es la reacción de anelación de Robinsón.
Síntesis. Las reacciones iniciales de la
síntesis, ya han sido explicadas abundantemente en la solución de las MOb
precedentes, sólo se deberá resaltar, que la reacción de condensanción
intramolecular requerida, es la reacción de anelación de Robinsón.
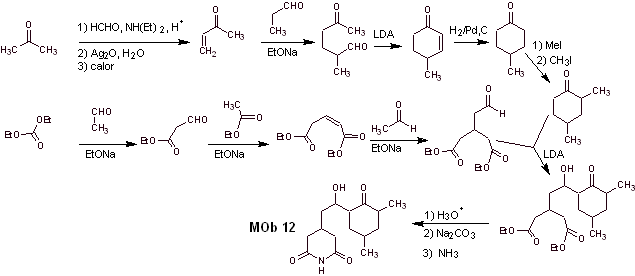
Solución MOb 12
Análisis retrosintético: La desconexión inicial por los enlaces amídicos, genera una molécula precursora con varias relaciones dioxigenadas, de ellas se selecciona la 1,3-diO, para dividir en dos fragmentos importantes la molécula y con cada uno de ellos proceder a las desconexiones necesarias para generar un diseño de una síntesis convergente.
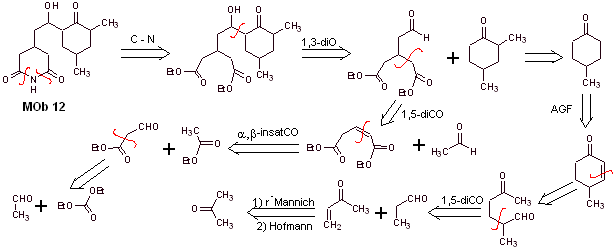
Síntesis. Un manejo adecuado de que un aldehído, generar hidrógenos más ácidos en su carbono alfa, es parte de una buena estrategia de síntesis.
Solución MOb 13
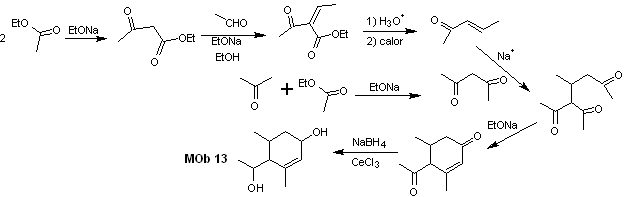
Análisis retrosintético. El compuesto dihidroxílico, MOb 13, se transforma en un compuesto dicarbonílico, para generar una molécula precursora, desconectable según el modelo α, β – insat.CO, para proceder con el 1,5-diCO y otros de esta naturaleza, hasta arribar a materiales de partida simples.
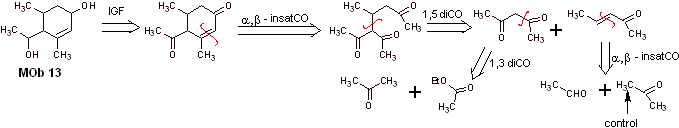 Síntesis. Se debe ejercer control en algunas reacciones de condensación catalizada
por bases, para evitar las respectivas autocondensaciones, que generara
rendimientos bajos de la síntesis.
Síntesis. Se debe ejercer control en algunas reacciones de condensación catalizada
por bases, para evitar las respectivas autocondensaciones, que generara
rendimientos bajos de la síntesis.
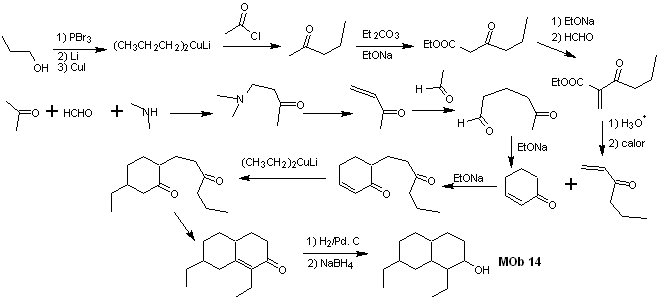
Solución MOb 14
Análisis retrosintético. Esta molécula tiene un parecido con la MOb 11, por lo que las desconexiones que se efectúen tendrán cierta similitud.
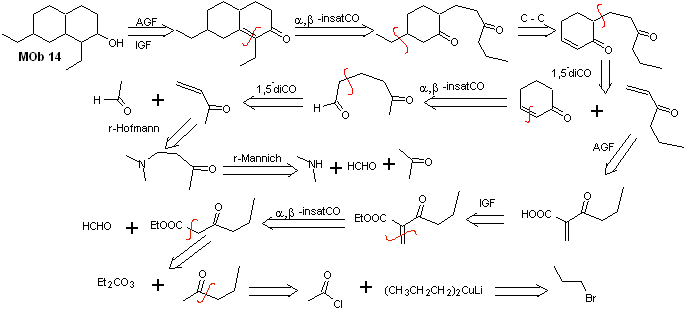 Síntesis
Síntesis
Solución MOb 15
Análisis retrosintético. La desconexión de los enlaces N-O de la lactama, permite generar una molécula precursora, que puede desconectarse según los modelos ya estudiados y de ejercer control para evitar las reacciones de competencia.
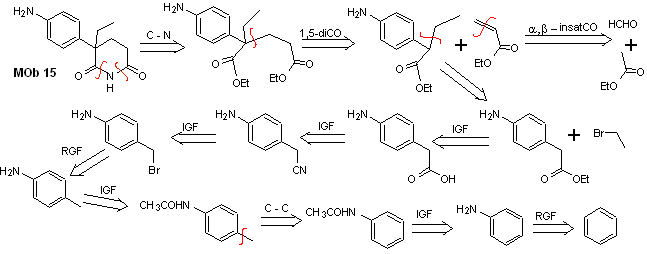 Síntesis. Todas las reacciones, hasta el
momento han sido reiteradamente explicadas, por lo que en el presente
ejercicio, se dará por sentado que, la química los compuestos dioxigenados,
requiere de medidas de control de la síntesis, para rectificar la misma a la
luz de los resultados obtenidos.
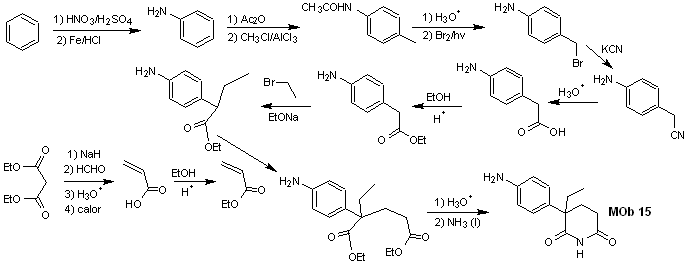
Síntesis. Todas las reacciones, hasta el
momento han sido reiteradamente explicadas, por lo que en el presente
ejercicio, se dará por sentado que, la química los compuestos dioxigenados,
requiere de medidas de control de la síntesis, para rectificar la misma a la
luz de los resultados obtenidos.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?






