¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
Fórmulas Moleculares
FÓRMULAS MOLECULARES
- Detalles
- Germán Fernández
- FÓRMULAS MOLECULARES
- Visto: 118833
- Detalles
- Germán Fernández
- FÓRMULAS MOLECULARES
- Visto: 128032
- Detalles
- Germán Fernández
- FÓRMULAS MOLECULARES
- Visto: 121506
A partir de la composición centesimal de un compuesto químico podemos determinar su formula empírica. La fórmula molecular se obtiene a partir de la empírica utilizando la masa molecular del compuesto, que puede determinarse mediante la espectrometría de masas.
- Detalles
- Germán Fernández
- FÓRMULAS MOLECULARES
- Visto: 111603
El índice de insaturación de una molécula se define como la suma del número de enlaces \(\pi\) y del número de ciclos presentes. Los alcanos son hidrocarburos saturados al no contener enlaces \(\pi\) ni ciclos y cumplen la fórmula molecular \(C_nH_{2n+2}\). Para calcular el índice de insaturación de un compuesto no tenemos más que comparar el número de hidrógenos que posee con los que tendría si fuera un alcano de igual número de carbonos. Esta diferencia de hidrógenos dividida entre 2 nos da el índice de insaturación.
- Detalles
- Germán Fernández
- FÓRMULAS MOLECULARES
- Visto: 119287
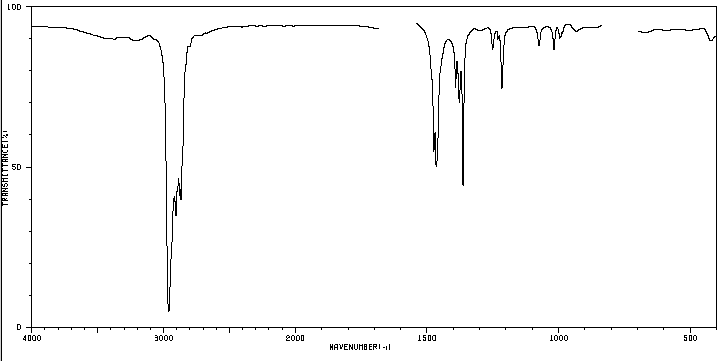
Un compuesto orgánico cuya composición centesimal es 83,63 % de carbono y 16,37 % de hidrógeno con masa molecular 86,11, presenta el siguente espectro de IR.