Las moléculas orgánicas distribuyen sus electrones en diferentes niveles electrónicos llamados orbitales moleculares. Los orbitales moleculares de menor energía son los $\sigma$, a continuación siguen los orbitales $\pi$. Cuando en la molécula existen átomos con pares electrónicos libres (oxígeno, azufre, nitrógeno, halógenos) tendremos niveles no enlazantes n. Estos niveles electrónicos se disponen en la región enlazante del diagrama. En la región antienlazante nos encontramos con los orbitales moleculares $\pi^{\ast}$ y $\sigma^{\ast}$. Una molécula en su estado fundamental tiene ocupados los orbitales enlazantes y no enlazantes y desocupados los antienlazntes.
De lo comentado anteriormente se deduce que las transiciones electrónicas deben partir de los orbitales enlazantes y no enlazantes terminando en los antienlazantes. Así podemos tener los 5 tipos de transiciones electrónicas que se muestran en el siguiente diagrama.
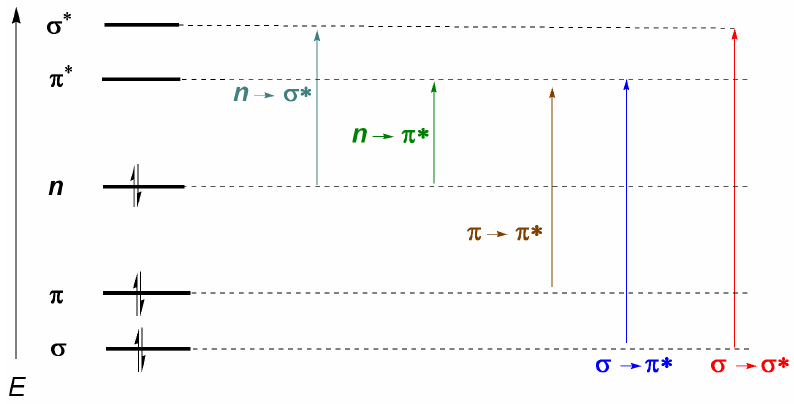
La transición electrónica más importante suele ser del HOMO (último orbital ocupado) al LUMO (primero orbital vacío) que corresponde al menor salto energético y le corresponde una longitud de onda grande.
En los alcanos solo son posibles transiciones $\sigma \rightarrow \sigma^{\ast}$ (etano: $\lambda =135\;nm$). Estas bandas no pueden ser observadas con los espectrofotómetros comerciales, puesto que hacen barridos a partir de los 200 nm. Sin embargo, las moléculas que presentan dobles enlaces conjugados presentan transiciones $\pi \rightarrow \pi^{\ast}$ que pueden ser observadas (butadieno: $\lambda =217\;nm$).
Cuando en la molécula existen átomos con pares libres, la transción de menor energía(mayor logitud de onda) es $n\rightarrow \pi$. Sin embargo, se trata de una transición poco probable, debido a que no existe solapamiento entre ambor orbitales, originando bandas muy débiles. De este último comentario se deduce la regla de selección de la espectroscopía visible-UV: las transiones $n\rightarrow \pi^{\ast}$ están "prohibidas". Entendiéndose por prohibida una transición de baja probabilidad.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?