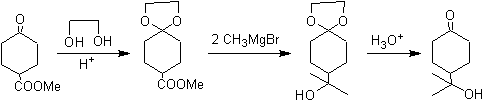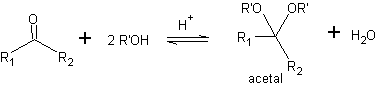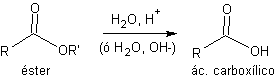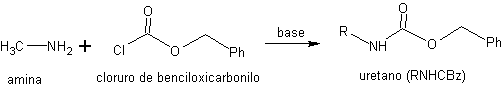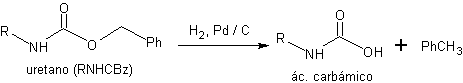En el diseño de síntesis de una molécula con varios grupos funcionales, es muy común que un reactivo que produce una transformación sobre un grupo funcional, afecte también a otro grupo presente en otra parte de la molécula. En los casos en que no se puede lograr una quimioselectividad adecuada sobre el grupo funcional que tiene que transformarse, el grupo que debe permanecer inalterado se protege convirtiéndolo temporalmente en una funcionalidad inerte a las condiciones de la reacción.
La operación de protección, requiere del siguiente procedimiento:
· Proteger el grupo o los grupos funcionales más reactivos selectivamente y en condiciones suaves.
· Efectuar la reacción sobre el grupo funcional requerido sin afectar el grupo protegido
· Desproteger el grupo funcional, sometido a protección
La acción de protección debe satisfacer los siguientes requisitos básicos:
· La reacción debe tener buen rendimiento y ser quimioselectiva
· El nuevo grupo funcional debe ser estable en las condiciones de la reacción del grupo que reaccionará
· La funcionalidad introducida no debe agregar centros quirales a la molécula que puedan generar diasterómeros
· El grupo funcional original debe poder regenerarse con buen rendimiento y sin afectar al resto de la molécula
El uso de protectores debe reducirse al mínimo indispensable y su elección debe ser tal que no se requiera reemplazarlos a lo largo de la síntesis ya que los pasos de introducción y remoción (desprotección) suman costo y trabajo a la síntesis y disminuyen el rendimiento. Ejemplo.
Se ha protegido el grupo cetónico de la molécula transformándolo en un cetal cíclico, con un etanodiol en medio ligeramente ácido, posteriormente se ha hecho reaccionar esta molécula con dos moles del bromuro de fenil magnesio, que actúa sobre el grupo éster, para transformarlo en un alcohol terciario, con dos sustituyentes metilo aportados por el Grignard. Finalmente se hidroliza el cetal cíclico para regenerar la cetona.
No existe en la práctica un grupo protector perfecto para cada funcionalidad, en cambio se puede afirmar de que existe una gran batería de protectores posibles, cada uno de los cuales cumple las condiciones anteriores en determinadas circunstancias. Una lista breve, de protección de los grupos más comunes, se recoge en los siguientes apartados:
PROTECCIÓN DE ALDEHÍDOS Y CETONAS
Una forma de protección de las cetonas y los aldehídos es su conversión en acetales. Los acetales se pueden desproteger en condiciones suaves mediante reacciones de hidrólisis ácida.
En la reducción de un cetoéster a cetoalcohol. La protección de la cetona en forma de acetal es muy conveniente porque el acetal resiste las condiciones reductoras en que se emplearán en la conversión del grupo éster en grupo hidroxilo.
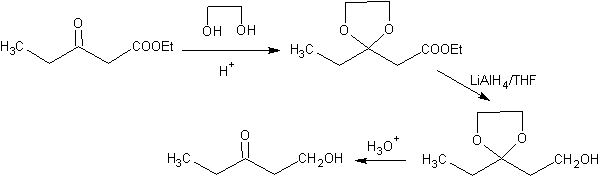
En el siguiente esquema se da la secuencia de síntesis completa que permite conseguir la reducción del éster sin afectar a la cetona:
En la primera etapa la cetona se convierte en un acetal cíclico por reacción con etilenglicol en presencia de un catalizador ácido. En la segunda etapa se reduce el éster con LiAlH4. Este reactivo no ataca al acetal. Finalmente, en la tercera etapa el alcohol-acetal se trata en medio ácido acuoso. En estas condiciones el acetal resulta hidrolizado regenerándose el grupo carbonilo cetónico. Cada una de las tres etapas es quimioselectiva puesto que en cada una de ellas se consigue la reacción preferente de un grupo funcional en presencia de otro.
PROTECCIÓN DE ÁCIDOS CARBOXÍLICOS
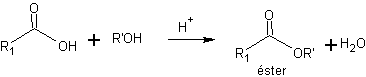
a) ésteres de etilo y metilo. La forma de protección más corriente de los ácidos carboxílicos es su conversión en ésteres.
Los ésteres más empleados son los de etilo y metilo que pueden obtenerse fácilmente mediante la reacción de esterificación de Fischer. La desprotección se lleva a cabo mediante la hidrólisis ácida o básica (saponificación) del grupo éster.
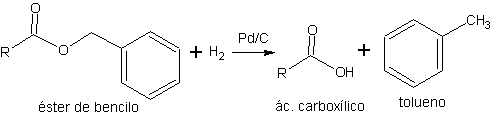
b) ésteres de bencilo La desprotección de ésteres de etilo o metilo puede ser problemática en sistemas polifuncionales debido a la elevada acidez o basicidad que se debe emplear en el proceso de hidrólisis. Por ello se emplean otro tipo de ésteres que permiten efectuar la etapa de desprotección en condiciones neutras o de baja acidez.
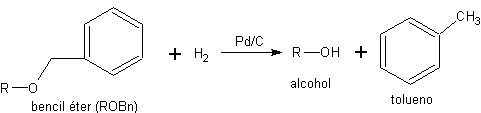
Los ésteres de bencilo se pueden desproteger mediante hidrogenólisis (ruptura de enlaces por H2) del enlace C-O, a temperatura ambiente y en condiciones neutras.
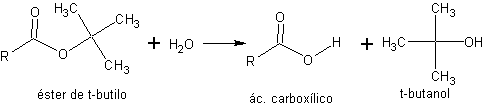
c) ésteres de t-butilo. Los ésteres de t-butilo se pueden hidrolizar fácilmente a los correspondientes ácidos carboxílicos, en condiciones suaves de acidez y temperatura ambiente, debido a la fácil formación del carbocatión t-butilo
PROTECCIÓN DE ALCOHOLES
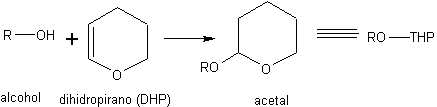
a) Como acetales. El DHP (dihidropirano) se emplea para la conversión de alcoholes en acetales mixtos. Como el alcohol se convierte en acetal, la desprotección se efectúa mediante hidrólisis ácida.
b) Como éteres de bencilo. Puesto que los éteres son uno de los grupos funcionales menos reactivos no es de extrañar que muchos de ellos se empleen como grupos protectores. Sin embargo, la inercia química de los éteres es un inconveniente a la hora de utilizarlos como grupos protectores porque la etapa de desprotección obliga, en muchos casos a la utilización de condiciones de reacción muy drásticas.
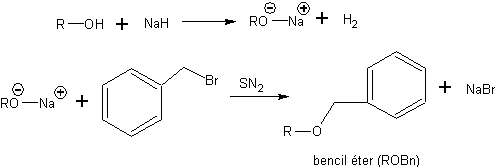
Es por ello que, en la práctica, el número de tipos de éter que se emplean como protectores de alcoholes se ve notablemente reducido. Uno de los éteres más empleados en el proceso de protección de alcoholes es el bencil éter (ROBn). La etapa de protección se consigue por la ionización previa del alcohol, por ejemplo con NaH, seguida de ataque SN2 del alcóxido generado sobre bromuro o cloruro de bencilo.
Los bencil éteres son muy populares entre los químicos orgánicos de síntesis porque conjugan una gran facilidad de introducción, una gran inercia química, y una gran quimioselectividad en la etapa de desprotección. La desprotección se efectúa en condiciones neutras y a temperatura ambiente, mediante una reacción de hidrogenólisis.
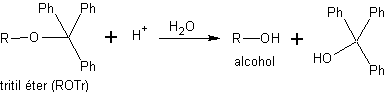
b) Como tritil éteres. Los tritil éteres, o éteres de trifenil metano, se emplean para la protección quimioselectiva de hidroxilos primarios. Los grupos hidroxilo secundario y terciario, al estar estéricamente más impedidos que los primarios, no forman éteres de tritilo porque el cloruro de trifenilmetilo (cloruro de tritilo) es un reactivo muy voluminoso.
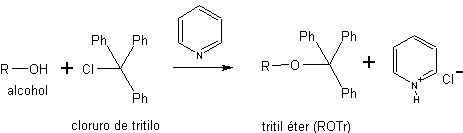
Los éteres de trifenilmetano (éteres de tritilo) se obtienen mediante la reacción de alcoholes primarios con el cloruro de tritilo en presencia de una base nitrogenada terciaria no nucleofílica, como la piridina. La misión de la base es neutralizar el HCl que se genera en la reacción. La desprotección de este tipo de éteres se consigue mediante una hidrólisis ácida suave. Los productos son dos alcoholes
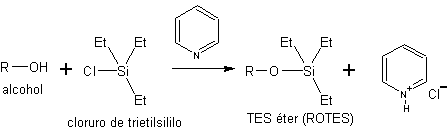
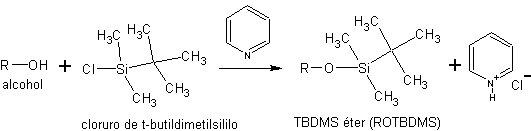
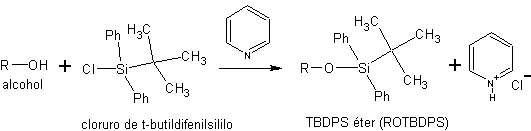
c) como silil éteres. Los silil éteres se obtienen por reacción de los alcoholes con cloruros de sililo. Como el cloruro de trietilsililo (Et3SiCl), el cloruro de t-butildimetilsililo (t-BuMe2SiCl) o el cloruro de t-butildifenilsililo (t-BuPh2SiCl).
La síntesis de estos éteres se efectúa en presencia de una base no nucleofílica para neutralizar el HCl que genera la reacción
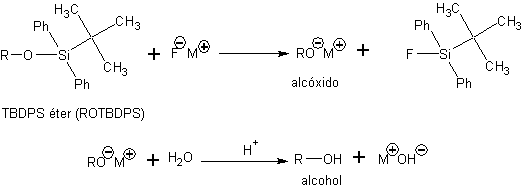
Los silil éteres se pueden desproteger de forma altamente quimioselectiva mediante la reacción con sales que contengan el anión fluoruro. Esta desprotección se basa en la fortaleza del enlace Si-F, uno de los enlaces covalentes más fuertes que existen, que impulsa la reacción hacia la formación del correspondiente fluorosilano
El otro producto de esta reacción es una sal del anión alcóxido (RO-M+). Para obtener el alcohol se procede a efectuar una etapa de hidrólisis para provocar la protonación del anión alcóxido.
El tamaño de los tres reactivos de sililación , aumenta en el siguiente orden:
Et3SiCl < t-Bu(CH3)2SuCl < t-Bu(Ph2)SiCl
Aumenta el tamaño del reactivo de sililación
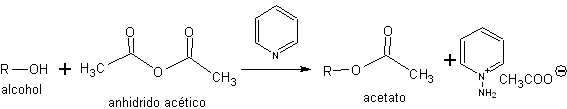
d) protección como ésteres. Los alcoholes también se pueden proteger mediante su conversión en ésteres.
Uno de los ésteres más comunes en la estrategia de protección-desprotección de alcoholes es el éster de ácido acético (acetatos)
PROTECCIÓN DE AMINAS
El par electrónico libre situado sobre el átomo de nitrógeno de las aminas es el responsable de la nucleofilia y de la basicidad de éstas. La forma evidente de ocultar las propiedades básicas y nucleofílicas de las aminas es su conversión en compuestos en los que el par electrónico del nitrógeno esté conjugado con un grupo electrón-atrayente.
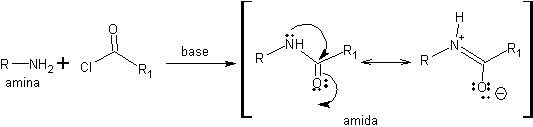
La conversión de aminas en amidas puede ser una buena solución para la protección de los grupos amino porque la deslocalización de la densidad electrónica asociada al átomo de nitrógeno disminuye la basicidad y la nucleofilia de este par electrónico.
Esta protección tiene un inconveniente: la etapa de desprotección. Las amidas son poco reactivas y la hidrólisis del grupo amida hay que efectuarla en condiciones de alta basicidad (o acidez) y temperatura que puede afectar a otros grupos funcionales presentes en la estructura. Por ello, las aminas se suelen proteger en forma de uretanos y no de amidas.
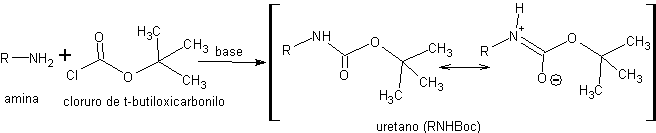
En los uretanos la densidad electrónica del átomo de nitrógeno también está disminuida por conjugación con un grupo carbonilo. La ventaja de estos protectores es que pueden eliminarse en condiciones suaves y muy quimioselectivas. Uno de los reactivos empleados en la protección de aminas en forma de uretanos es el cloruro de t-butiloxicarbonilo. Los uretanos obtenidos con este reactivo se abrevian como RNHBoc
La reacción de los RNHBoc con ácidos acuosos, en condiciones suaves de acidez y temperatura, genera un ácido carbámico que es inestable y se descarboxila in situ dando lugar a la amina libre. Otro tipo de uretanos empleados en la protección de aminas son los que se obtienen en la reacción con cloruro de benciloxicarbonilo.
Las aminas (RNH2) protegidas como uretanos de benciloxicarbonilo se abrevian como RNHCBz
Estos uretanos se desprotegen en condiciones neutras mediante una reacción de hidrogenólisis.
Desprotección de N-CBz derivados:
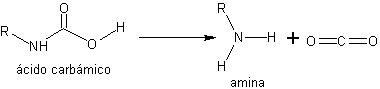
1º. Generación del ácido carbámico por hidrogenólisis
2º. Descarboxilación espontánea del ácido carbámico
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?