¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
|
Bienvenido,
Invitado
|
TEMA:
Acid/Base en ciclo alquenos 14 años 5 meses antes #4997
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
Re: Acid/Base en ciclo alquenos 14 años 5 meses antes #4998
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
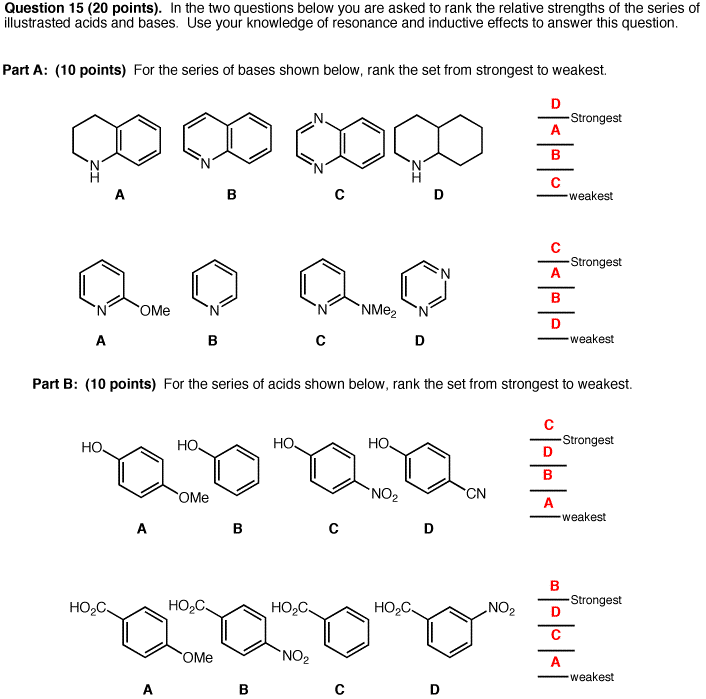
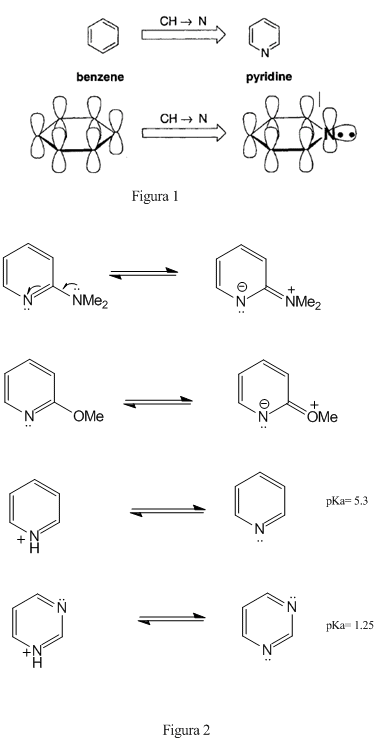
Acid/Base 6 años 8 meses antes #11953
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
Acid/Base 6 años 8 meses antes #11954
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |