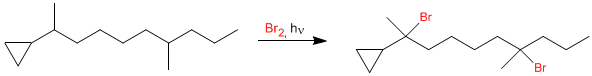¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
-
BiobulletM
-
 Autor del tema Autor del tema
-
Mensajes: 2
-
-
|
Bien, en una guia que nos han dejado, sale una reaccion asi.
(Es Br2, disculpen que se me haya olvidado agregarlo  )
Y ayer hablando con mis compañeros, salieron varios compañeros diciendo que el ciclopropano se romperia, siendo el efecto del exceso... pero eso no me entra en la cabeza, mi mente se rehusa a asimilarlo porque siento que algo no esta bien.
Alguien aqui podria confimarmelo o o hacerme saber como es en realidad, que no he logrado encontrar un texto que diga lo contrario, ni que confirme ese detalle
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
|
|
Hola, bienvenido al foro. El bromo halogena las posiciones terciarias a mucha mayor velocidad que las primarias y secundarias. El carbono del ciclopropano que se une a la cadena también es posición terciaria, pero genera radicales de menor estabilidad, debido a la tensión anular, por lo que se halogenará en menor proporción. Aunque si añades un exceso importante de halógeno se continuarán sustituyendo hidrógenos secundarios y primarios. En el dibujo sólo considero dos equivalentes de bromo.
Es cierto que los ciclopropanos pueden romperse debido a su importante tensión anular. Por ejemplo, calentando a 500ºC o por hidrogenación catalítica. Sin embargo, nunca he visto su apertura en condiciones de halogenación radicalaria, corríjanme si me equivoco.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
-
BiobulletM
-
 Autor del tema Autor del tema
-
Mensajes: 2
-
-
|
Gracias por responder, aunque salieron otras dudas.
Entonces el ciclopropano no es necesariamente el que toma la reaccion, Significa esto que un ciclo junto a una cadena son equivalentes en cuanto a la hora de tomar el cambio en la reaccion? (ya sea mientras no se presenten enlaces dobles-triples o sustituyentes de otro tipo)
Hasta donde tengo entendido, los cicloalcanos se sustituyen al estar un halogeno y las condiciones son luz (ultra violeta) o calor (e imagino que simplemente se satura de Br si hay exceso de este y luz)
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
|
|
Efectivamente, el ciclopropano no es grupo funcional y reacciona de igual manera que la cadena frente a la halogenación, pero debido a su tensión los radicales a través de los cuales transcurre la reacción son más inestables, por eso se halogena peor que la cadena. Un gran exceso de bromo podría ir sustituyendo todos los hidrógenos por halógenos, siempre que no exista algún efecto estérico que lo impida.
Saludos
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación.
|
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?