|
Bienvenido,
Invitado
|
TEMA:
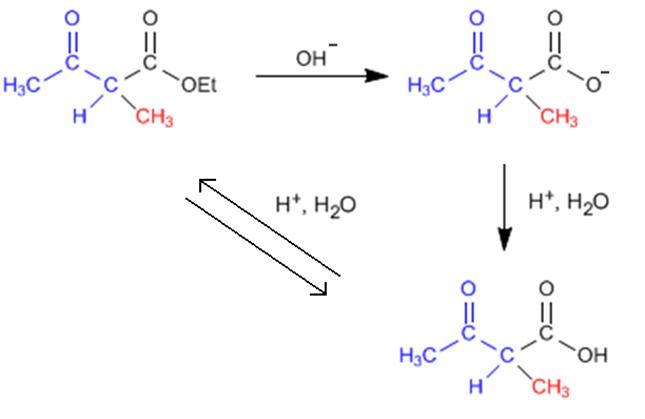
DUDA SINTESIS ACETOACETICA 14 años 5 días antes #2353
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
Re: DUDA SINTESIS ACETOACETICA 14 años 5 días antes #2354
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
Re: DUDA SINTESIS ACETOACETICA 14 años 2 días antes #2364
|
|
Por favor, Identificarse o Crear cuenta para unirse a la conversación. |
Tiempo de carga de la página: 0.199 segundos