Existen varios criterios para determinar el grado de aromaticidad de un heterociclo:
A) Longitudes de enlace.
Un heterociclos es tanto más aromático cuanto menor diferencia exista entre las longitudes de los diferentes enlaces que componen el anillo. El benceno tiene igual longitud en todos sus enlaces carbono-carbono lo que lo convierte en el compuesto más aromático. Los heterociclos presentan diferencias en las distancias de enlace, siendo menos aromáticos cuanto mayores sean estas diferencias.
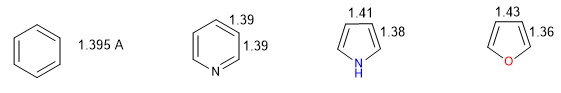
Todos los enlace C-C en el benceno miden 1.395 A, una distancia de enlace intermedia entre el enlace simpre (1.48 A) y el doble (1.34 A). En el furano se aprecia una diferencia notable entre la longitud de los enlaces, indicando una menor aromaticidad que en el pirrol. La piridina por el contrario tiene unas distancias de enlace C-C muy similares entre ellas y parecidas a las del benceno, lo que muestra una mayor aromaticidad que en pirrol o furano.
B) Datos de resonancia magnética nuclear.
Otra medida del grado de aromaticidad consiste en comparar las constantes de acoplamiento de los diferentes hidrógenos. Si las distancias de enlace entre carbonos son iguales las constantes de acoplamiento entre los hidrógenos unidos a ellos también son iguales. Los sistemas aromáticos presentan un desplazamiento químico comprendido entre 7 y 8.5 ppm debido al fenómeno de la anisotropía magnética.
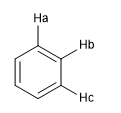
Jab = Jbc si las distancias Ca - Cb y Cb - Cc son iguales, lo que muestra un sistema de elevada aromaticidad.
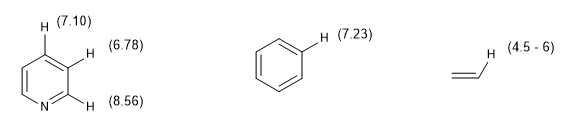
El desplazamiento químico de los hidrógenos aromáticos permite fácilmente distinguirlos de los hidrógenos vinílicos.
C) Energías de resonancia.
Se utilizan los datos REPE (energía de resonancia por electrón pi) para comparar el grado de aromaticidad de diferentes heterociclos.
El REPE se obtiene dividiendo la energía de resonancia de un sistema entre el número de electrones pi que posee. Podemos definir la energía de resonancia como la diferencia de energía entre la molécula con enlaces localizados y deslocalizados.
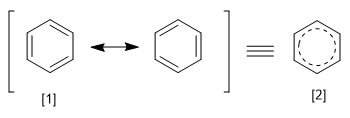
[1 ] Estructura canónica
[2 ] Híbrido de resonancia
| Compuesto | REPE |
| Benceno Piridina Pirimidina Pirrol Tiofeno Furano |
0.065 0.058 0.049 0.039 0.032 0.007 |
Cuanto más electronegativo es el heteroátomo, menos aromaticidad presenta el heterociclo, puesto que los electrones pi se ven atraídos por este y disminuye la conjugación. Este factor explica la mayor aromaticidad de pirrol frente a furano. En heterociclos con heteroátomos de similar electronegatividad, pero en los que un heteroátomo posee orbitales d, presenta mayor aromaticidad el que no tiene orbitales d. Los orbitales d al ser más difusos dan solapamientos menos efectivos con los átomos de carbono y perjudican la conjugación. Este factor explica la mayor aromaticidad del pirrol frente al tiofeno.
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?