Enestereoquímica, la inducción asimétrica(tambiénenantio-inducción) en unareacción químicadescribe la formación preferencial de unenantiómeroodiastereómerosobre el otro, como resultado de la influencia de una característicaquiralpresente en elsustrato,reactivo,catalizadoro ambiente. La inducción asimétrica es un elemento clave en lasíntesis asimétrica.
La inducción asimétrica fue introducida porEmil Fischer, basado en su trabajo sobre loscarbohidratos. Existen varios tipos de inducción.
Lainducción asimétrica internahace uso de un centro quiral unido al centro reactivo por medio de unenlace covalente, y permanece así durante la reacción. En lainducción asimétrica por relayla información quiral es introducida en un paso separado, y eliminado nuevamente en una reacción química separada. Los sintones especiales son denominadosauxiliares quirales. En lainducción asimétrica externa, la información quiral es introducida en elestado de transicióna través de uncatalizadoroligando quiral. Este método desíntesis asimétricaes económicamente el más deseable.
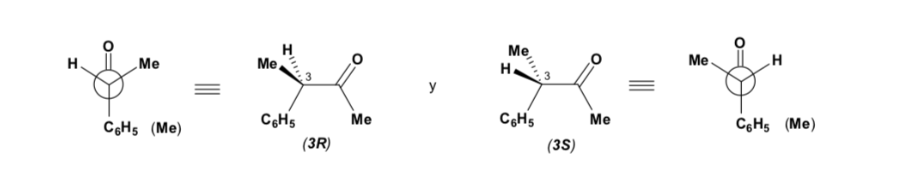
Estereoselectividad en la reaccion de adicion nucleofilica a carbonilos (Reglas de Cram)
En las reacciones de adición nucleófila, el átomo de carbono del grupo carbonilo puede transformarse en un átomo de carbono asimétrico, dependiendo del tipo de nucleófilo empleado y de los radicales alquilo que están unidos inicialmente al C=O.
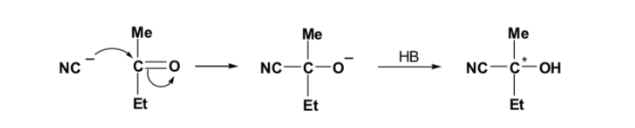
Si el compuesto carbonílico y el nucleófilo no son quirales se obtiene una mezcla equimolecular de dos enantiómeros (racémico):
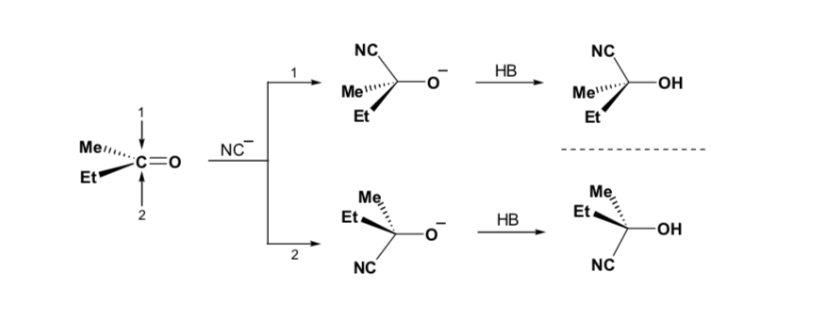
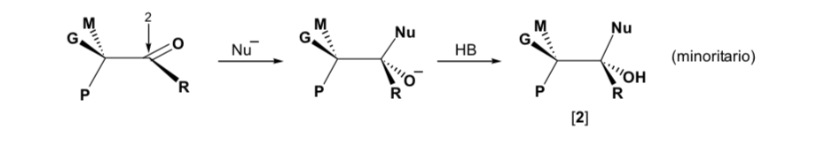
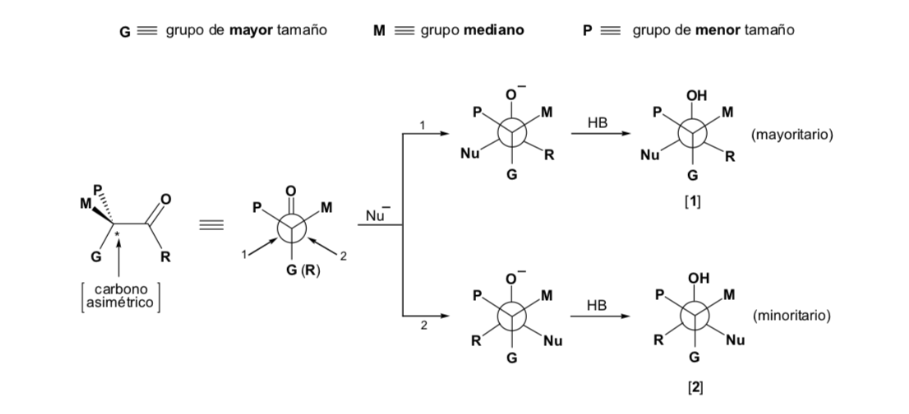
Sin embargo, cuando el compuesto carbonílico es quiral, la probabilidad de que el nucleófilo reaccione por cada una de las dos caras del grupo carbonilo no es la misma. El impedimento estéreo hace que la reacción por una de las caras esté favorecida, y el resultado es una mezcla de diastereoisómeros en proporciones diferentes (inducción asimétrica):
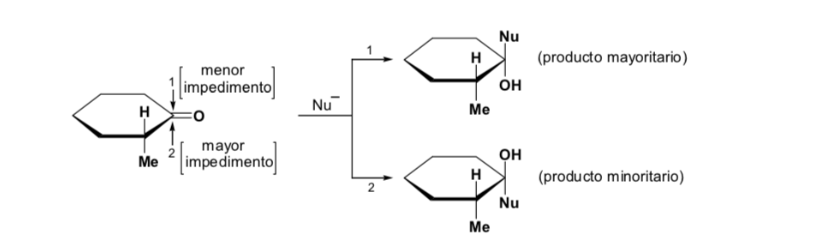
El diastereoisómero mayoritario se forma cuando el nucleófilo reacciona con el grupo carbonilo por el lado menos impedido, y la conformación del sustrato es aquella en la que el grupo carbonilo está flanqueado por los grupos menos voluminosos unidos al Cα asimétrico.
[grupo carbonilo flanqueado por los grupos menos voluminosos: H y Me]
La regla de Cram se refiere a la reacción de uno de los estereoisómeros que forman la pareja de enantiómeros, no a la reacción del racémico con el nucleófilo.
El nucleófilo se aproxima por el lado en que están situados P y G:
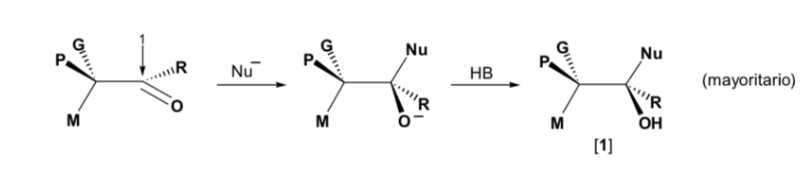
El nucleófilo se aproxima por el lado en que están situados M y G:

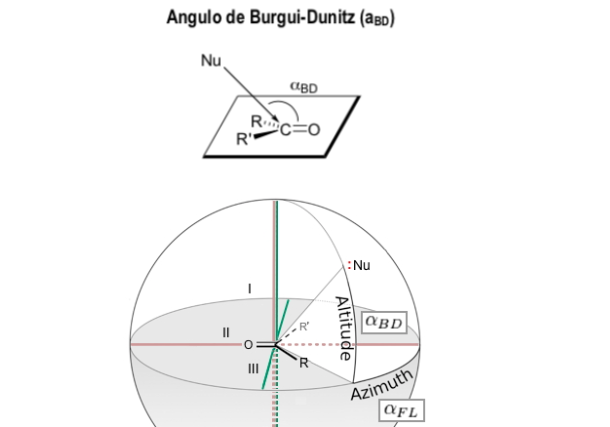
Angulo de Bürgi-Dunitz
El ángulo Bürgi-Dunitz (ángulo BD) es uno de los dos ángulos que definen completamente la geometría de "ataque" (aproximación por colisión) de un nucleófilo en un centro trigonal insaturado en una molécula, originalmente el centro carbonilo en una cetona orgánica, pero ahora se extiende a los carbonilos de aldehído, éster y amida, y también a los alquenos (olefinas).
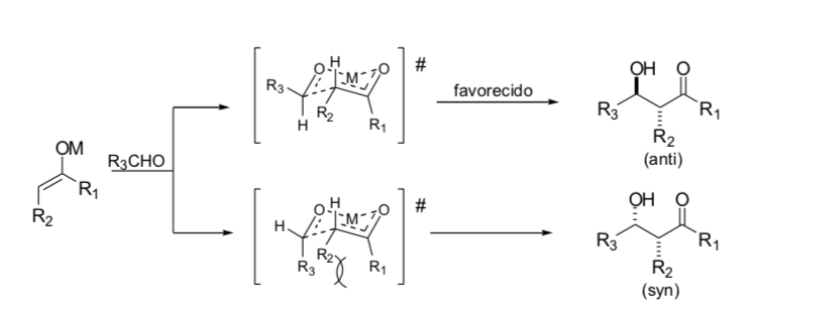
Modelo de zimmerman - traxler
Zimmerman y Traxler propusieron que la reacción aldólica con enolatos metálicos se produce a través de un proceso pericíclico similar a una silla. En la práctica, la estereoquímica puede ser altamente dependiente del metal. Solo unos pocos metales, como el boro, siguen de manera confiable las vías indicadas.
Tension alilica
En estereoquimica la tensión alílica o tensión 1,3-alílica es una energía de tensión que resulta de una conformación molecular desfavorable para el grupo alilo, producto de la interacción entre un sustituyente en un extremo de una olefina con un sustituyente alílico del otro extremo.
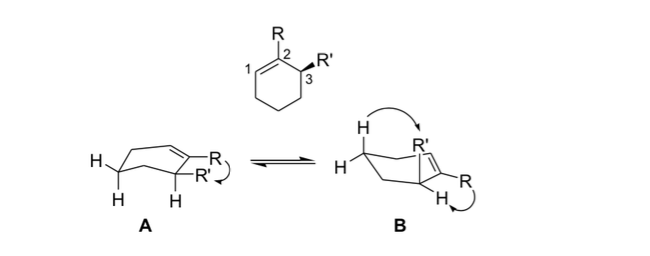
Los químicos orgánicos usan esta rigidez resultante de la tensión alílica para obtener reacciones asimétricas.
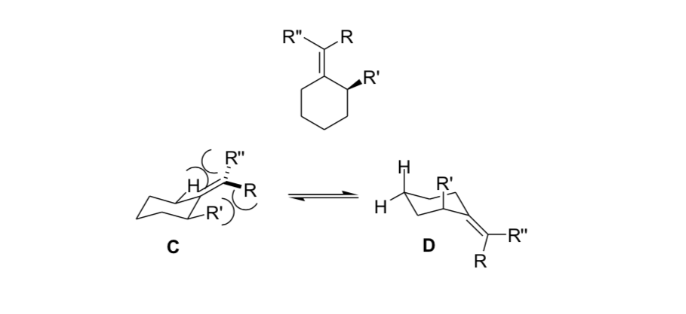
Substitución en la posición alfa de enolatos: introducción de un centro estereogénico nuevo :
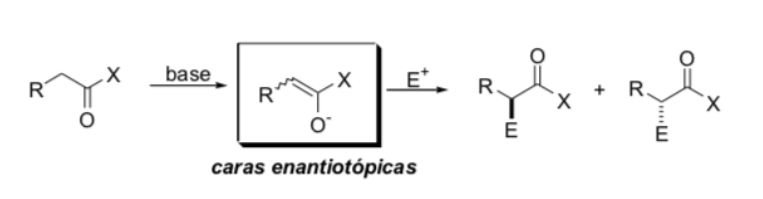
Factores que controlan la estereoselectividad
a) geometría del enolato
b) fuentes de quiralidad presentes ya sea en el enolato o en el electrofilo (fuente de información asimétrica)
c) efectos estereoelectrónicos
Fuentes para expandir informacion :
1) Guo-Qiang Lin, Yue-Ming Li, Albert S. C. Chan. Principles and Applications of Asymmetric Synthesis. Ed. Wiley-Interscience. Great Britain, 2001.
2) Mark Rizzacasa and Michael Perkins. Stoichiometric Asymmetric Synthesis. Ed. Sheffield Academic Press. U.S.A and Canada. 2000.
3) Jonathan M. J. Williams. Catalysis in Asymmetric Synthesis. Ed. Sheffield Academic Press. U.S.A and Canada. 1999.
4) R. A. Aitken and S.N. Kulényi. Asymmetric Synthesis. Ed. Blackie Academic and Professional. Great Britain, 1992.
5) Grossman R.B. The Art of Writing Reasonable Organic Reaction Mechanisms. Springer, New York. 2003
6) Norman R.O.C.; Coxon J. M. Principles of Organic Synthesis. CRC Press, Boca Ratón. 1993









