Em estereoquímica, indução assimétrica (também enantio-indução) em um reação química descreve a formação preferencial de um enantiômero qualquer diastereômero por outro, como resultado da influência de uma característica quiral presente no substrato, reagente, catalisador ou ambiente. A indução assimétrica é um elemento-chave na síntese assimétrica.
A indução assimétrica foi introduzida por Emil Fischer, com base em seu trabalho sobre a carboidratos. Existem vários tipos de indução.
O indução assimétrica interna utiliza um centro quiral ligado ao centro reativo por meio de um ligação covalente, e assim permanece durante a reação. No indução de relé assimétrico a informação quiral é introduzida em uma etapa separada e removida novamente em uma reação química separada. Os sintetizadores especiais são chamados auxiliares quirais. No indução assimétrica externa, a informação quiral é introduzida no Estado de transição através de um catalisador qualquer ligante quiral. Este método de síntese assimétrica é economicamente o mais desejável.
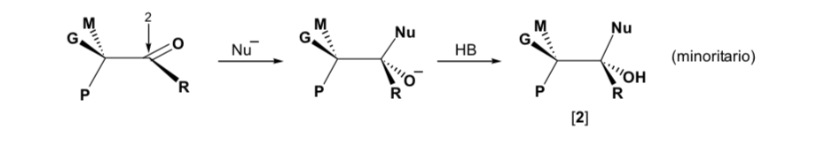
Estereosseletividade na reação de adição nucleofílica a carbonilas (Regras de Cram)
Nas reações de adição nucleofílica, o átomo de carbono do grupo carbonila pode se transformar em um átomo de carbono assimétrico, dependendo do tipo de nucleófilo utilizado e dos radicais alquila inicialmente ligados ao C=O.
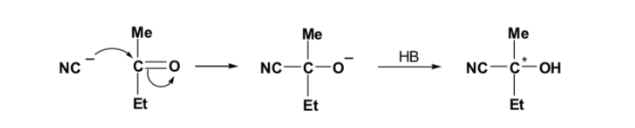
Se o composto carbonílico e o nucleófilo não forem quirais, obtém-se uma mistura equimolar de dois enantiômeros (racêmico):
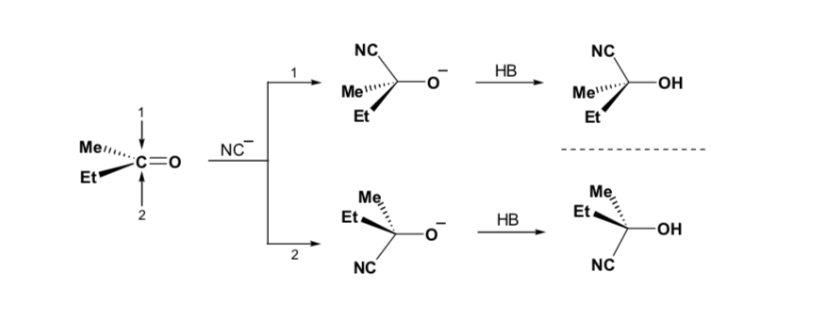
No entanto, quando o composto carbonílico é quiral, a probabilidade de o nucleófilo reagir por cada uma das duas faces do grupo carbonílico não é a mesma. O impedimento estéreo faz com que a reação em uma das faces seja favorecida, e o resultado é uma mistura de diastereoisômeros em diferentes proporções ( indução assimétrica ):
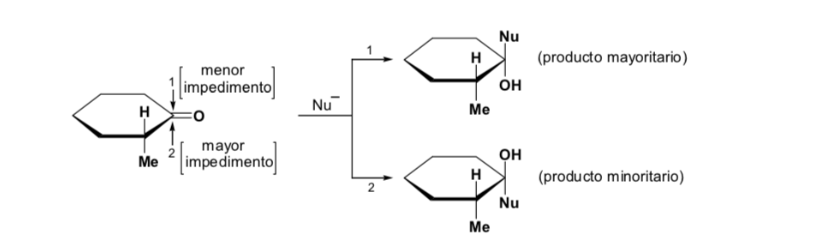
O diastereômero principal é formado quando o nucleófilo reage com o grupo carbonila no lado menos impedido, e a conformação do substrato é aquela em que o grupo carbonila é flanqueado pelos grupos menos volumosos ligados ao Cα assimétrico.
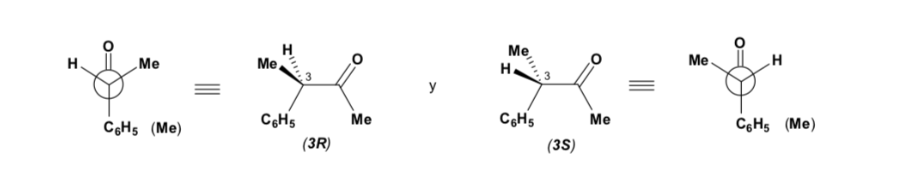
[grupo carbonila flanqueado pelos grupos menos volumosos: H e Me ]
A regra de Cram refere-se à reação de um dos estereoisômeros que formam o par de enantiômeros, não à reação do racêmico com o nucleófilo.
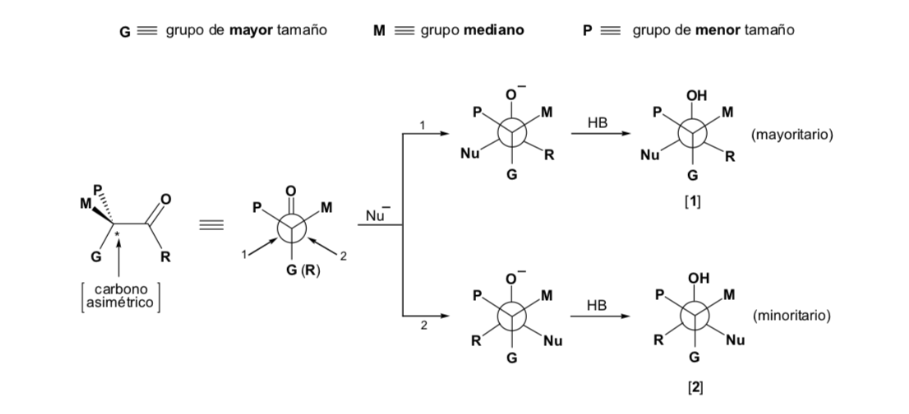
O nucleófilo é abordado pelo lado onde P e G estão localizados:
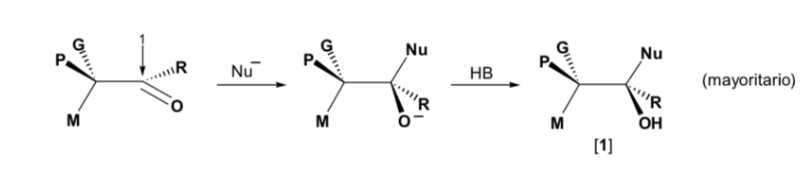
O nucleófilo é abordado pelo lado onde M e G estão localizados:

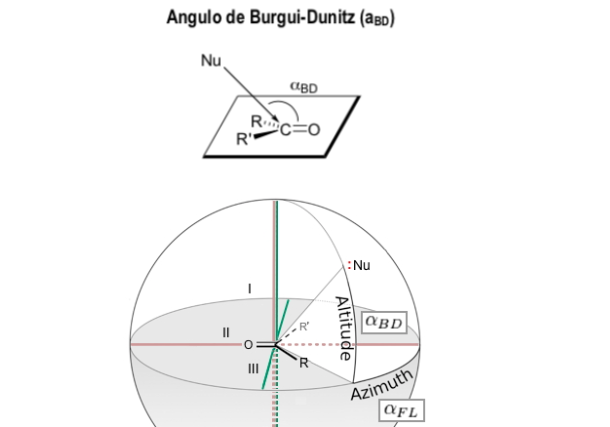
Ângulo de Burgi-Dunitz
O ângulo Bürgi-Dunitz (ângulo BD) é um dos dois ângulos que definem completamente a geometria de "ataque" (aproximação de colisão) de um nucleófilo em um centro trigonal insaturado em uma molécula, originalmente o centro carbonílico em uma cetona orgânica, mas agora é estendida a carbonilas de aldeído, éster e amida, e também a alcenos (olefinas).
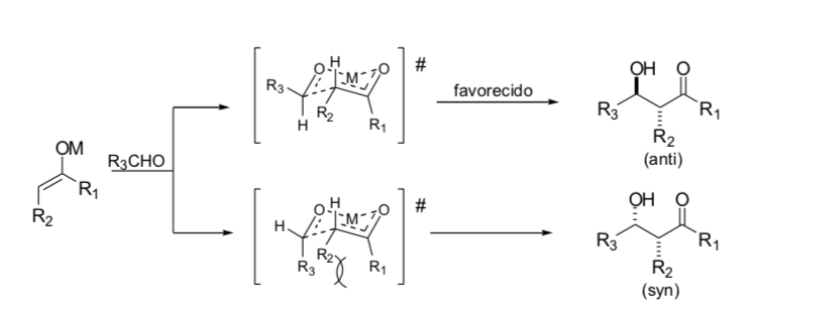
Modelo Zimmerman - traxler
Zimmerman e Traxler propuseram que a reação aldólica com enolatos de metal ocorre por meio de um processo pericíclico semelhante a uma cadeira. Na prática, a estereoquímica pode ser altamente dependente do metal. Apenas alguns metais, como o boro, seguem de forma confiável os caminhos indicados.
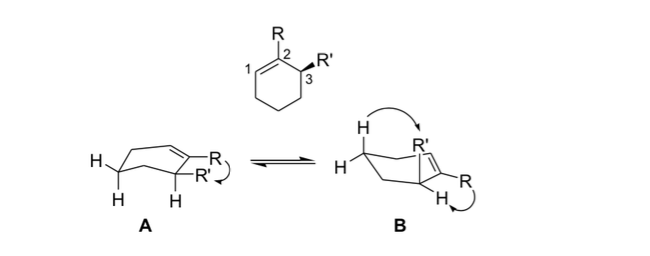
tensão alílica
Em estereoquímica, a tensão alílica ou tensão 1,3-alílica é uma energia de tensão que resulta de uma conformação molecular desfavorável para o grupo alila, produto da interação entre um substituinte em uma extremidade de uma olefina com um substituinte alílico na outra extremidade.
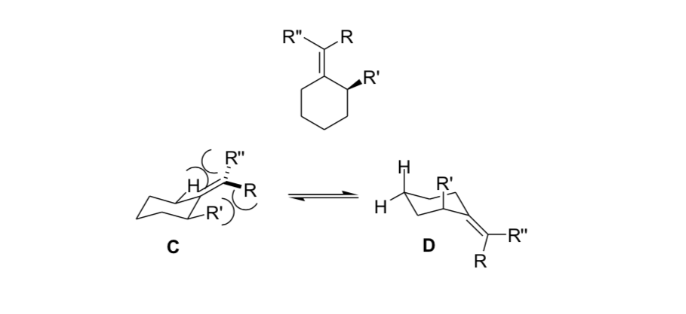
Os químicos orgânicos usam essa rigidez resultante da tensão alílica para obter reações assimétricas.
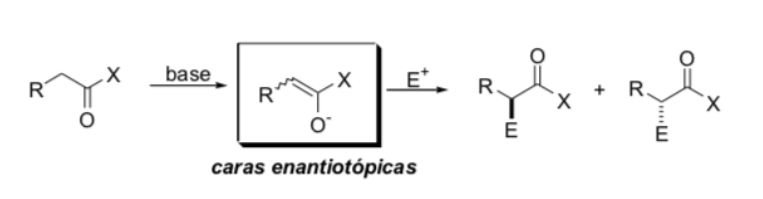
Substituição na posição alfa de enolatos: introdução de um novo centro estereogênico:
Fatores que controlam a estereosseletividade
a) geometria enolada
b) fontes de quiralidade presentes no enolato ou no eletrófilo (fonte de informação assimétrica)
c) efeitos estereoeletrônicos
Fontes para expandir as informações:
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Princípios e Aplicações da Síntese Assimétrica. Ed. Wiley-Interscience. Grã-Bretanha, 2001.
2) Mark Rizzacasa e Michael Perkins. Síntese Assimétrica Estequiométrica. Ed. Sheffield Academic Press. EUA e Canadá. 2000.
3) Jonathan MJ Williams. Catálise em Síntese Assimétrica. Ed. Sheffield Academic Press. EUA e Canadá. 1999.
4) RA Aitken e SN Kulényi. Síntese Assimétrica. Ed. Blackie Acadêmico e Profissional. Grã-Bretanha, 1992.
5) Grossman RB A Arte de Escrever Mecanismos de Reação Orgânica Razoáveis. Springer, Nova York. 2003
6) Norman ROC; Coxon JM Princípios de Síntese Orgânica. CRC Press, Boca Raton. 1993









