Dans stéréochimie, induction asymétrique (aussi énantio-induction) dans un réaction chimique décrit la formation préférentielle d'un énantiomère soit diastéréoisomère d'autre part, sous l'influence d'une caractéristique chiral présent dans le substrat, réactif, catalyseur ou environnement. L'induction asymétrique est un élément clé de la synthèse asymétrique.
L'induction asymétrique a été introduite par Emil Fischer, d'après ses travaux sur la crabes. Il existe plusieurs types d'induction.
La induction asymétrique interne utilise un centre chiral relié au centre réactif au moyen d'un liaison covalente, et le reste pendant la réaction. Dans la induction de relais asymétrique les informations chirales sont introduites dans une étape séparée, et supprimées à nouveau dans une réaction chimique séparée. Les synthons spéciaux sont appelés auxiliaires chiraux. Dans la induction asymétrique externe, des informations chirales sont introduites dans état de transition à travers un catalyseur soit ligand chiral. Cette méthode de synthèse asymétrique c'est économiquement le plus souhaitable.
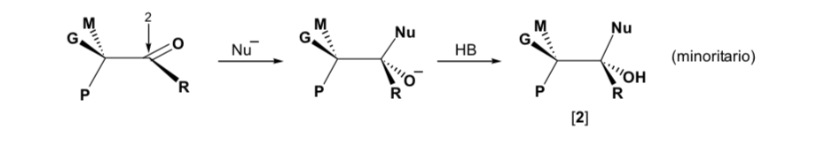
Stéréosélectivité dans la réaction d'addition nucléophile aux carbonyles (règles de Cram)
Dans les réactions d'addition nucléophiles, l'atome de carbone du groupe carbonyle peut être transformé en un atome de carbone asymétrique, selon le type de nucléophile utilisé et les radicaux alkyle initialement fixés au C=O.
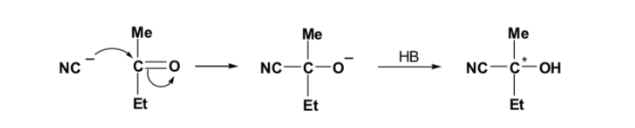
Si le composé carbonylé et le nucléophile ne sont pas chiraux, on obtient un mélange équimolaire de deux énantiomères (racémique) :
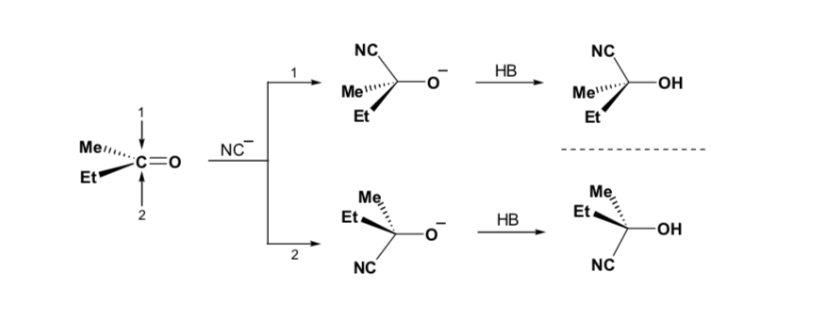
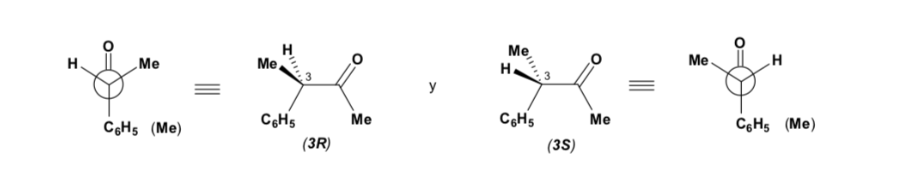
Cependant, lorsque le composé carbonyle est chiral, la probabilité que le nucléophile réagisse par chacune des deux faces du groupe carbonyle n'est pas la même. L'encombrement stéréo provoque la réaction sur l'une des faces à favoriser, et le résultat est un mélange de diastéréoisomères dans des proportions différentes ( induction asymétrique ) :
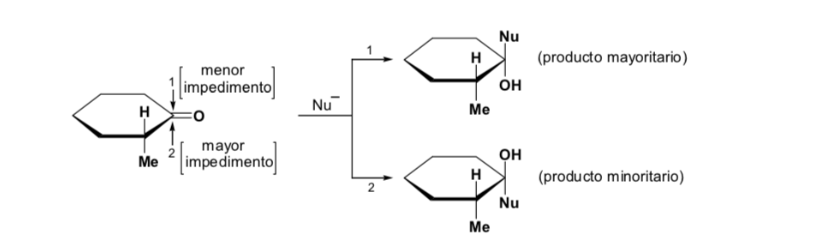
Le diastéréoisomère majeur est formé lorsque le nucléophile réagit avec le groupe carbonyle du côté le moins encombré, et la conformation du substrat est celle dans laquelle le groupe carbonyle est flanqué des groupes les moins volumineux attachés au Cα asymétrique.
[groupe carbonyle flanqué des groupes les moins volumineux : H et Me ]
La règle de Cram fait référence à la réaction de l'un des stéréoisomères qui forment la paire d'énantiomères, et non à la réaction du racémique avec le nucléophile.
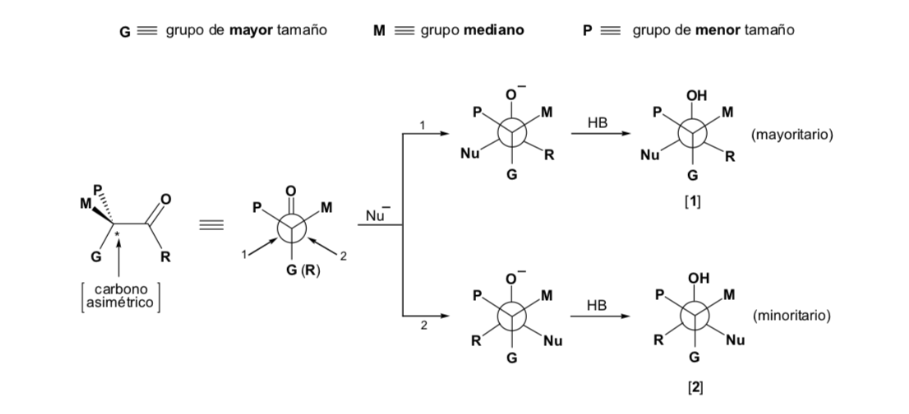
Le nucléophile est approché du côté où se situent P et G :
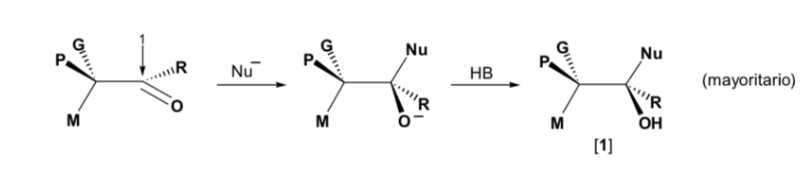
Le nucléophile est approché du côté où se situent M et G :

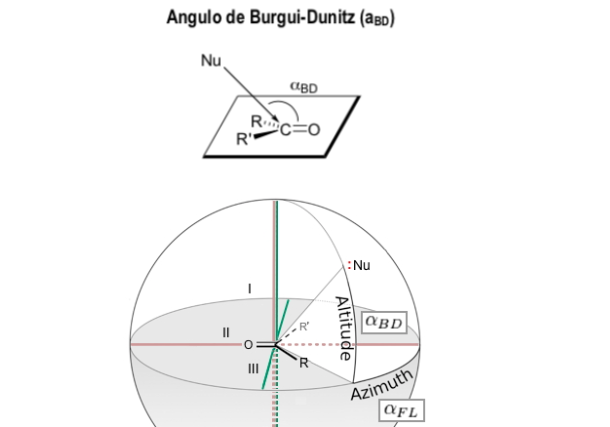
Angle de Burgi-Dunitz
L'angle de Bürgi-Dunitz (angle BD) est l'un des deux angles qui définissent complètement la géométrie "d'attaque" (approximation de collision) d'un nucléophile sur un centre trigonal insaturé dans une molécule, à l'origine le centre carbonyle d'une cétone organique, mais maintenant il est étendu aux aldéhydes, esters et amides carbonyles, ainsi qu'aux alcènes (oléfines).
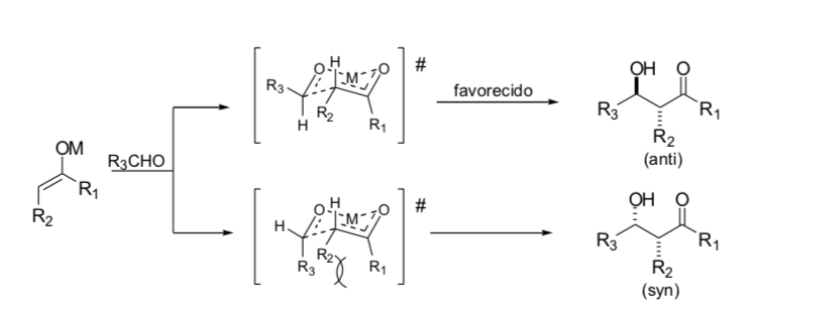
Modèle Zimmerman - Traxler
Zimmerman et Traxler ont proposé que la réaction aldol avec les énolates métalliques se produise via un processus péricyclique semblable à une chaise. En pratique, la stéréochimie peut être fortement dépendante du métal. Seuls quelques métaux, comme le bore, suivent de manière fiable les voies indiquées.
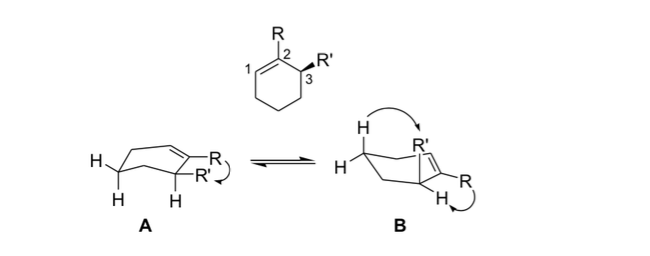
stress allylique
En stéréochimie, la tension allylique ou tension 1,3-allylique est une énergie de tension qui résulte d'une conformation moléculaire défavorable pour le groupe allyle, produit de l'interaction entre un substituant à une extrémité d'une oléfine avec un substituant allylique à l'autre extrémité.
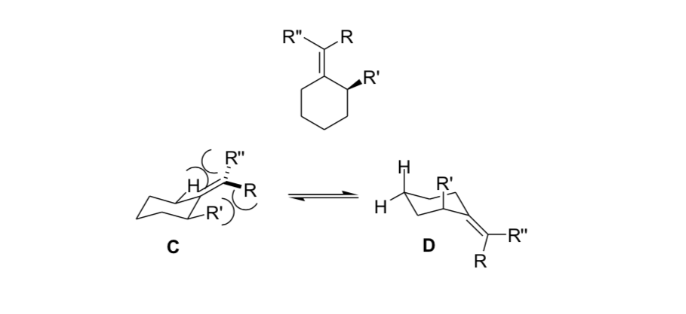
Les chimistes organiques utilisent cette raideur résultant de la déformation allylique pour obtenir des réactions asymétriques.
Substitution en position alpha des énolates : introduction d'un nouveau centre stéréogène :
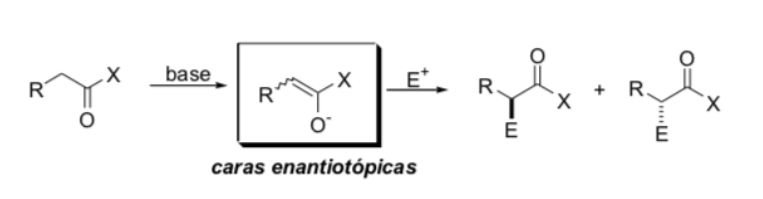
Facteurs contrôlant la stéréosélectivité
a) géométrie des énolates
b) sources de chiralité présentes soit dans l'énolate soit dans l'électrophile (source d'information asymétrique)
c) effets stéréoélectroniques
Sources pour élargir les informations :
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Principes et applications de la synthèse asymétrique. Ed. Wiley-Interscience. Grande-Bretagne, 2001.
2) Mark Rizzacasa et Michael Perkins. Synthèse asymétrique stoechiométrique. Ed. Sheffield Academic Press. États-Unis et Canada. 2000.
3) Jonathan MJ Williams. Catalyse en synthèse asymétrique. Ed. Sheffield Academic Press. États-Unis et Canada. 1999.
4) RA Aitken et SN Kulényi. Synthèse asymétrique. Ed. Blackie Académique et Professionnel. Grande-Bretagne, 1992.
5) Grossman RB L'art d'écrire des mécanismes de réaction organique raisonnable. Springer, New York. 2003
6) Norman ROC; Coxon JM Principes de synthèse organique. CRC Press, Boca Raton. 1993







