In stereochimica, induzione asimmetrica (Anche enantio-induzione) in a reazione chimica descrive la formazione preferenziale di a enantiomero O diastereomero dall'altro, come risultato dell'influenza di una caratteristica chirale presente nel substrato, reagente, catalizzatore o ambiente. L'induzione asimmetrica è un elemento chiave nella sintesi asimmetrica.
L'induzione asimmetrica è stata introdotta da Emil Fischer, basato sul suo lavoro sul carboidrati. Esistono diversi tipi di induzione.
IL induzione asimmetrica interna si avvale di un centro chirale collegato al centro reattivo mediante a legame covalente e rimane tale durante la reazione. Nel induzione relè asimmetrica le informazioni chirali vengono introdotte in una fase separata e rimosse nuovamente in una reazione chimica separata. Vengono chiamati i synthon speciali ausiliari chirali. Nel induzione asimmetrica esterna, l'informazione chirale viene introdotta nel stato di transizione attraverso un catalizzatore O ligando chirale. Questo metodo di sintesi asimmetrica è economicamente il più desiderabile.
Stereoselettività nella reazione di addizione nucleofila ai carbonili (regole di Cram)
Nelle reazioni di addizione nucleofila, l'atomo di carbonio del gruppo carbonilico può essere trasformato in un atomo di carbonio asimmetrico, a seconda del tipo di nucleofilo utilizzato e dei radicali alchilici che sono inizialmente attaccati al C=O.
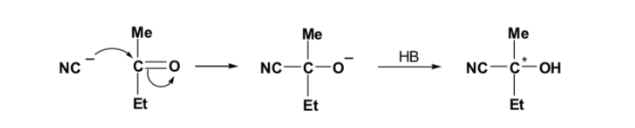
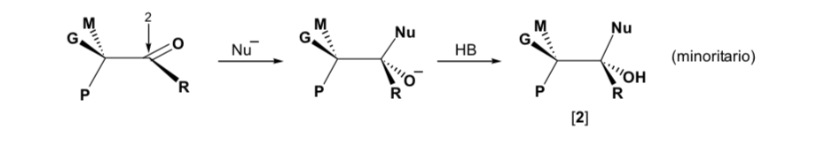
Se il composto carbonilico e il nucleofilo non sono chirali, si ottiene una miscela equimolare di due enantiomeri (racemica):
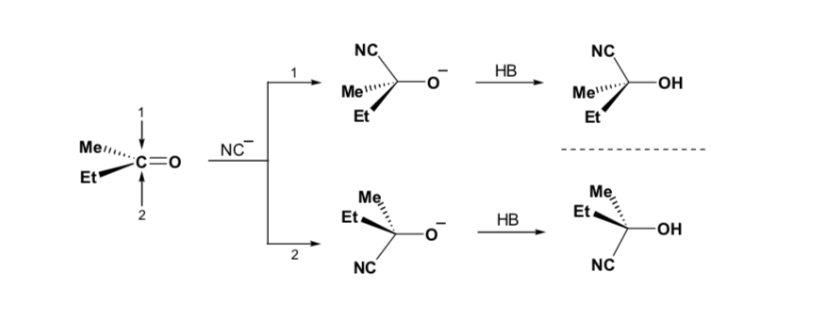
Tuttavia, quando il composto carbonilico è chirale, la probabilità che il nucleofilo reagisca per ciascuna delle due facce del gruppo carbonilico non è la stessa. L'impedimento stereo fa sì che la reazione su una delle facce sia favorita e il risultato è una miscela di diastereoisomeri in proporzioni diverse ( induzione asimmetrica ):
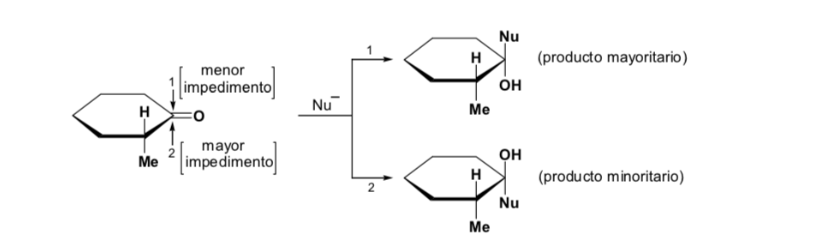
Il diastereomero maggiore si forma quando il nucleofilo reagisce con il gruppo carbonilico sul lato meno ingombrato, e la conformazione del substrato è quella in cui il gruppo carbonilico è affiancato dai gruppi meno ingombranti attaccati al Cα asimmetrico.
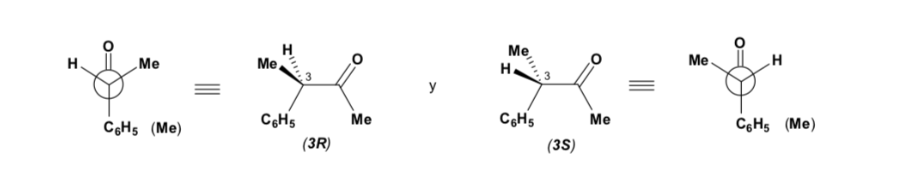
[gruppo carbonilico affiancato dai gruppi meno ingombranti: H e Me ]
La regola di Cram si riferisce alla reazione di uno degli stereoisomeri che formano la coppia di enantiomeri, non alla reazione del racemo con il nucleofilo.
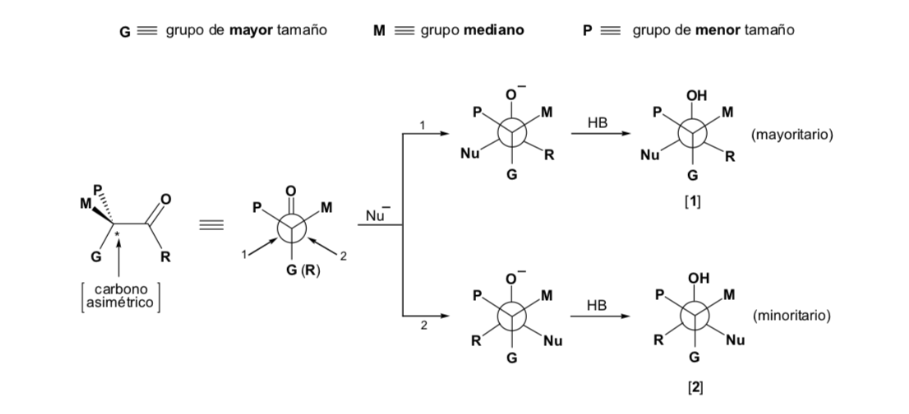
Il nucleofilo viene avvicinato dal lato in cui si trovano P e G :
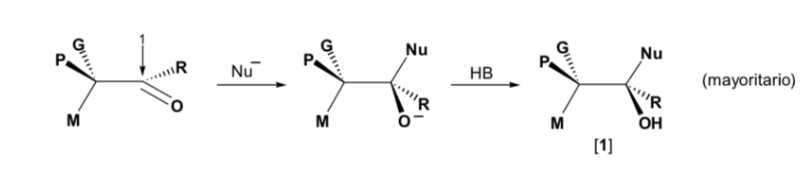
Il nucleofilo viene avvicinato dal lato in cui si trovano M e G :

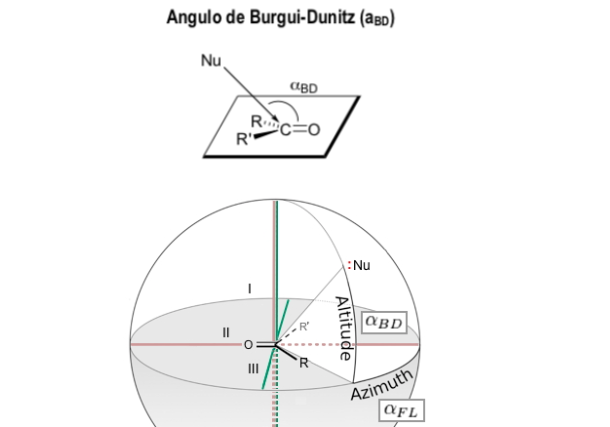
Angolo di Burgi-Dunitz
L'angolo di Bürgi-Dunitz (angolo BD) è uno dei due angoli che definiscono completamente la geometria di "attacco" (approssimazione di collisione) di un nucleofilo su un centro trigonale insaturo in una molecola, originariamente il centro carbonilico in un chetone organico, ma ora è esteso ad aldeidi, esteri e ammidi carbonili e anche ad alcheni (olefine).
Modello Zimmerman - traxler
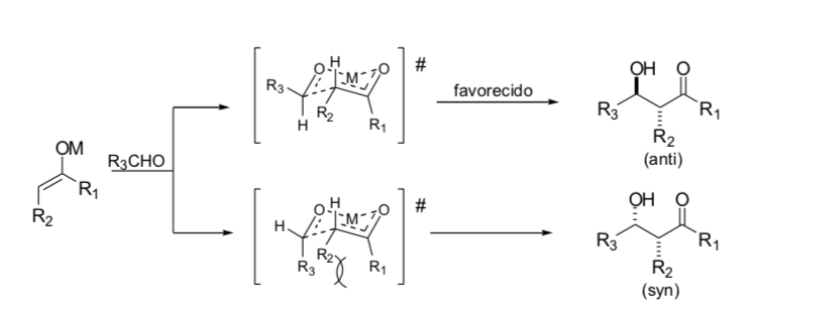
Zimmerman e Traxler hanno proposto che la reazione aldolica con gli enolati metallici avvenga tramite un processo periciclico simile a una sedia. In pratica, la stereochimica può essere fortemente dipendente dal metallo. Solo pochi metalli, come il boro, seguono in modo affidabile i percorsi indicati.
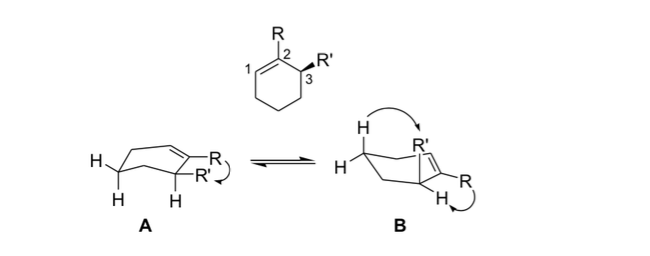
stress allilico
Nella stereochimica, la tensione allilica o tensione 1,3-allilica è un'energia di tensione che risulta da una conformazione molecolare sfavorevole per il gruppo allilico, prodotto dell'interazione tra un sostituente a un'estremità di un'olefina con un sostituente allilico all'altra estremità.
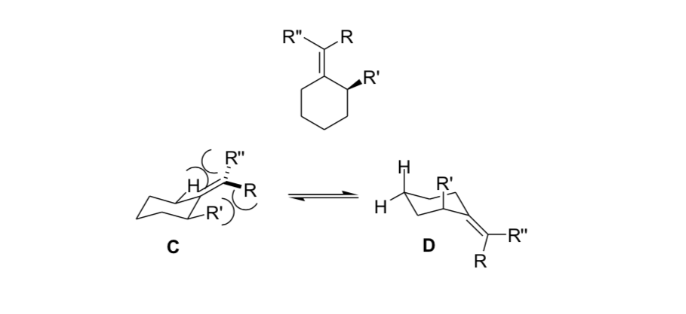
I chimici organici usano questa rigidità risultante dalla deformazione allilica per ottenere reazioni asimmetriche.
Sostituzione in posizione alfa degli enolati: introduzione di un nuovo centro stereogenico:
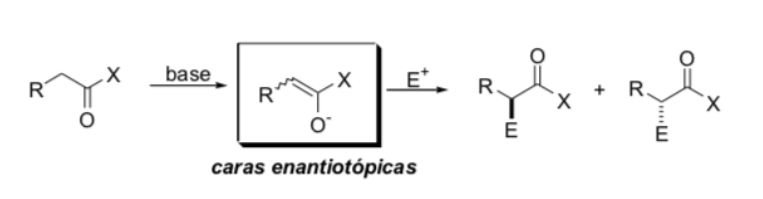
Fattori che controllano la stereoselettività
a) geometria enolata
b) fonti di chiralità presenti nell'enolato o nell'elettrofilo (fonte di informazione asimmetrica)
c) effetti stereoelettronici
Fonti per espandere le informazioni:
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Principi e applicazioni della sintesi asimmetrica. Ed. Wiley-Interscience. Gran Bretagna, 2001.
2) Mark Rizzacasa e Michael Perkins. Sintesi stechiometrica asimmetrica. Ed. Stampa accademica di Sheffield. USA e Canada. 2000.
3) Jonathan MJ Williams. Catalisi in sintesi asimmetrica. Ed. Stampa accademica di Sheffield. USA e Canada. 1999.
4) RA Aitken e SN Kulényi. Sintesi asimmetrica. Ed. Blackie accademico e professionale. Gran Bretagna, 1992.
5) Grossman RB L'arte di scrivere meccanismi di reazione organici ragionevoli. Springer, New York. 2003
6) ROC normanna; Coxon JM Principi di sintesi organica. CRC Press, Boca Raton. 1993









