In Stereochemie, asymmetrische Induktion (Auch Enantio-Induktion) in a chemische Reaktion beschreibt die bevorzugte Bildung von a Enantiomer entweder Diastereomer andererseits durch den Einfluss eines Merkmals chiral vorhanden in der Substrat, Reagens, Katalysator oder Umwelt. Asymmetrische Induktion ist ein Schlüsselelement in der asymmetrische Synthese.
Asymmetrische Induktion wurde eingeführt von Emil Fischer, basierend auf seinen Arbeiten über die Kohlenhydrate. Es gibt mehrere Induktionsarten.
Der interne asymmetrische Induktion verwendet ein Chiralitätszentrum, das mit dem reaktiven Zentrum verbunden ist durch a kovalente Bindung, und bleibt so während der Reaktion. Im asymmetrische Relaisinduktion chirale Information wird in einem separaten Schritt eingeführt und in einer separaten chemischen Reaktion wieder entfernt. Die speziellen Synthons werden aufgerufen chirale Hilfsstoffe. Im externe asymmetrische Induktion, in die chirale Information eingeführt wird Übergangszustand durch ein Katalysator entweder chiraler Ligand. Diese Methode von asymmetrische Synthese es ist wirtschaftlich am wünschenswertesten.
Stereoselektivität bei der nukleophilen Addition an Carbonyle (Cramsche Regeln)
Bei nucleophilen Additionsreaktionen kann das Kohlenstoffatom der Carbonylgruppe in Abhängigkeit von der Art des verwendeten Nucleophils und der anfänglich an C=O gebundenen Alkylreste in ein asymmetrisches Kohlenstoffatom umgewandelt werden.
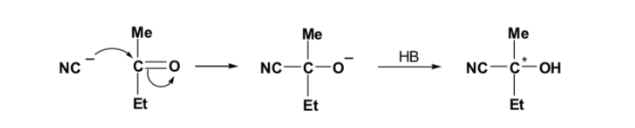
Wenn die Carbonylverbindung und das Nucleophil nicht chiral sind, wird ein äquimolares Gemisch zweier Enantiomere (racemisch) erhalten:
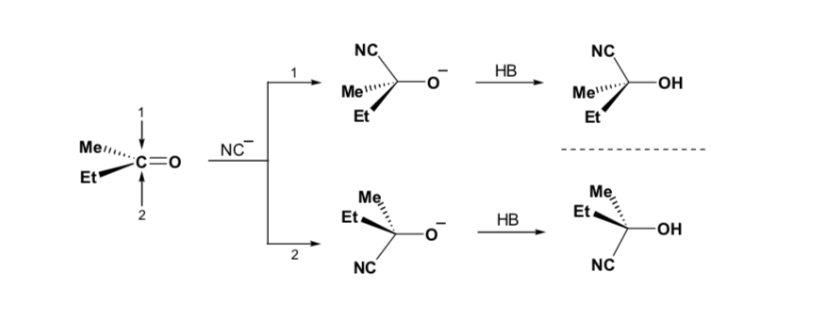
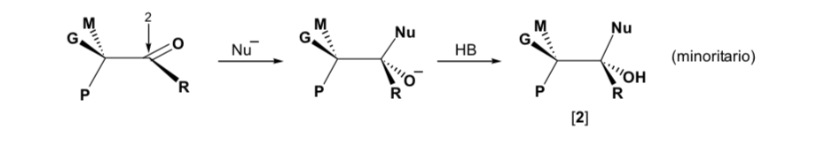
Wenn die Carbonylverbindung jedoch chiral ist, ist die Wahrscheinlichkeit, dass das Nucleophil mit jeder der beiden Seiten der Carbonylgruppe reagiert, nicht gleich. Stereohinderung bewirkt, dass die Reaktion auf einer der Seiten bevorzugt wird, und das Ergebnis ist ein Gemisch von Diastereoisomeren in unterschiedlichen Anteilen ( asymmetrische Induktion ):
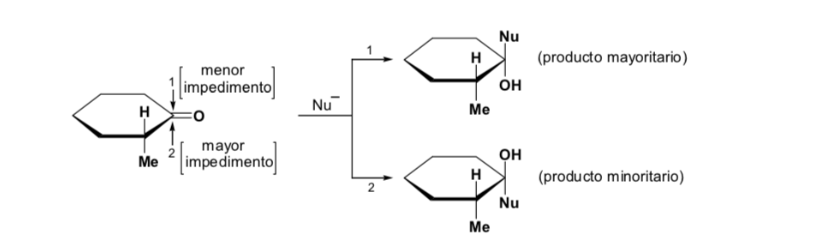
Das Hauptdiastereomer wird gebildet, wenn das Nucleophil mit der Carbonylgruppe auf der am wenigsten gehinderten Seite reagiert, und die Konformation des Substrats ist eine, bei der die Carbonylgruppe von den weniger voluminösen Gruppen flankiert wird, die an das asymmetrische Cα gebunden sind.
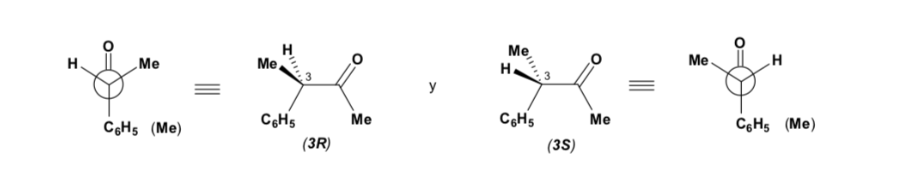
[Carbonylgruppe flankiert von den weniger voluminösen Gruppen: H und Me ]
Die Cram-Regel bezieht sich auf die Reaktion eines der Stereoisomere , die das Enantiomerenpaar bilden, nicht auf die Reaktion des Racemats mit dem Nucleophil.
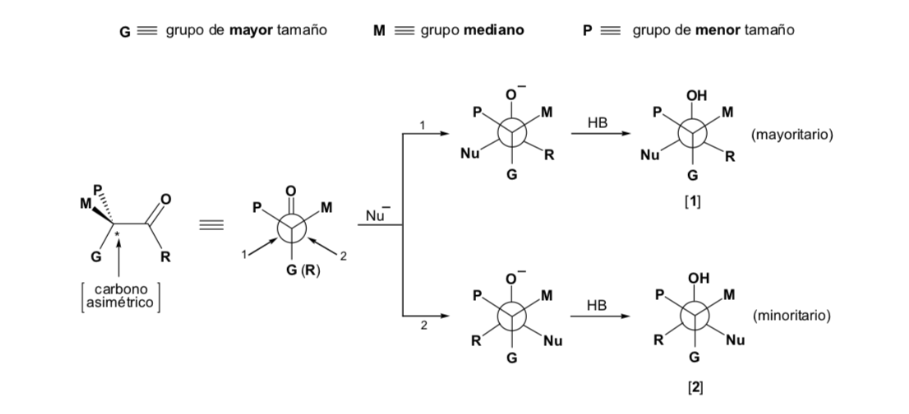
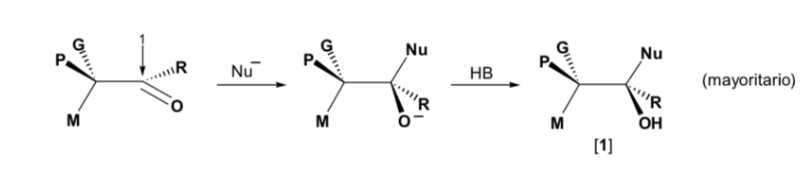
Das Nukleophil wird von der Seite angefahren, auf der sich P und G befinden:
Das Nukleophil wird von der Seite angefahren, auf der sich M und G befinden:

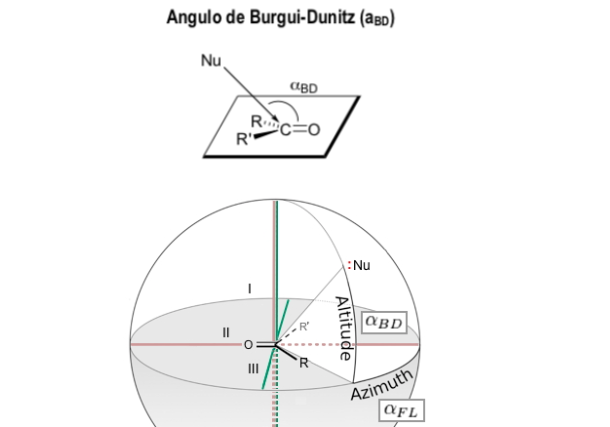
Burgi-Dunitz-Winkel
Der Bürgi-Dunitz-Winkel (BD-Winkel) ist einer von zwei Winkeln, die die „Angriffs“-Geometrie (Kollisionsnäherung) eines Nucleophils auf ein ungesättigtes trigonales Zentrum in einem Molekül, ursprünglich das Carbonylzentrum in einem organischen Keton, aber jetzt vollständig definieren wird auf Aldehyd-, Ester- und Amidcarbonyle sowie auf Alkene (Olefine) ausgedehnt.
Zimmermann-Modell - Traxler
Zimmerman und Traxler schlugen vor, dass die Aldolreaktion mit Metallenolaten über einen sesselartigen pericyclischen Prozess abläuft. In der Praxis kann die Stereochemie stark vom Metall abhängen. Nur wenige Metalle wie Bor folgen zuverlässig den angegebenen Wegen.
allylischer Stress
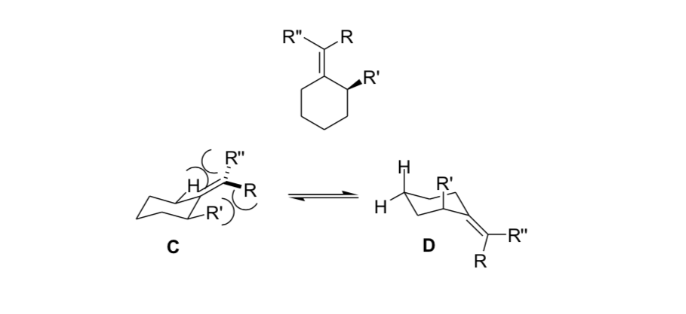
In der Stereochemie ist Allylspannung oder 1,3-Allylspannung eine Spannungsenergie, die aus einer ungünstigen molekularen Konformation für die Allylgruppe resultiert, ein Produkt der Wechselwirkung zwischen einem Substituenten an einem Ende eines Olefins mit einem Allylsubstituenten am anderen Ende.
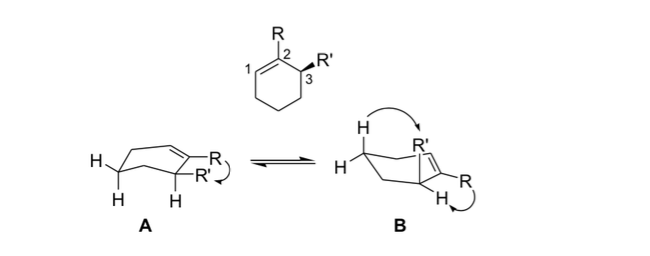
Organische Chemiker nutzen diese aus der allylischen Spannung resultierende Steifheit, um asymmetrische Reaktionen zu erhalten.
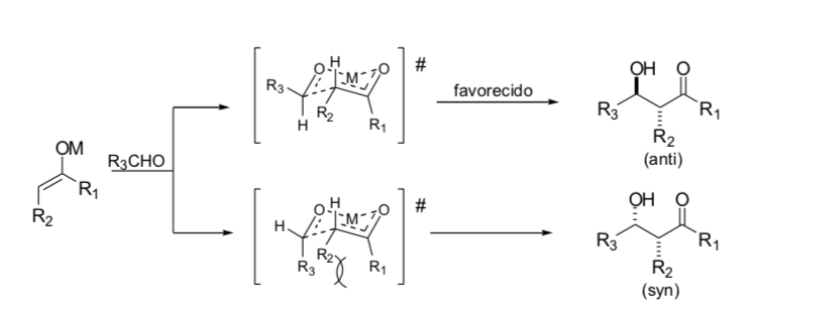
Substitution an der Alpha-Position von Enolaten: Einführung eines neuen stereogenen Zentrums:
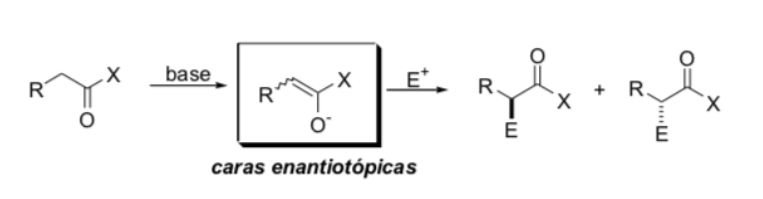
Faktoren, die die Stereoselektivität steuern
a) Enolatgeometrie
b) Chiralitätsquellen, die entweder im Enolat oder im Elektrophil vorhanden sind (Quelle asymmetrischer Information)
c) Stereoelektronische Effekte
Quellen zur Informationserweiterung:
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Prinzipien und Anwendungen der asymmetrischen Synthese. Hrsg. Wiley-Interscience. Großbritannien, 2001.
2) Mark Rizzacasa und Michael Perkins. Stöchiometrische asymmetrische Synthese. Hrsg. Sheffield Academic Press. USA und Kanada. 2000.
3) Jonathan MJ Williams. Katalyse in der asymmetrischen Synthese. Hrsg. Sheffield Academic Press. USA und Kanada. 1999.
4) RA Aitken und SN Kulényi. Asymmetrische Synthese. Hrsg. Blackie Academic and Professional. Großbritannien, 1992.
5) Grossman RB Die Kunst, vernünftige organische Reaktionsmechanismen zu schreiben. Springer, NewYork. 2003
6) Normannisches ROC; Coxon JM Prinzipien der organischen Synthese. CRC Press, Boca Raton. 1993









