sintesi del fenantrene
(Metodo dell'albero di sintesi)
Il fenantrene è un idrocarburo aromatico policiclico, che contiene tre anelli benzenici fusi, motivo per cui è un isomero dell'antracene.
| O |
|
I metodi tradizionali di sintesi del fenantrene, quelli che prevedono la formazione di cicli e la loro successiva "aromatizzazione", sono legati a quelli proposti da Haworth e Bardhan - Sengupta (1932), come si vedrà in seguito.
È anche possibile proporre altri nuovi metodi, per il fenantrene e in generale per i composti aromatici policiclici, sulla base dell'uso appropriato delle reazioni di accoppiamento di Ullman, della reazione di Heck, della reazione di Suzuki e della reazione di MacMurry, nonché della varianti ed estensioni che presentano queste reazioni.
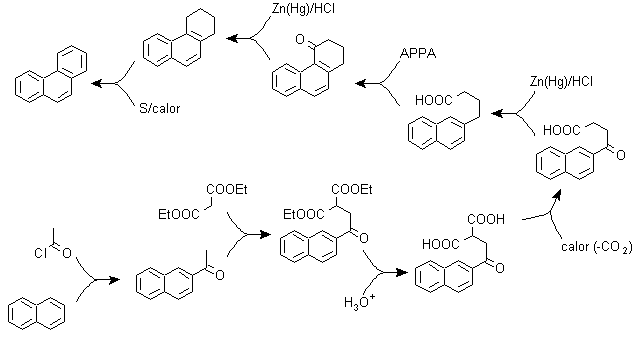
A) La sintesi di Haworth:
Questo metodo si basa sulla reazione di acilazione di Friedel-Crafts e presenta l'inconveniente che la ciclizzazione finale per formare il terzo anello fuso al naftalene non è selettiva, perché è possibile che la chiusura avvenga anche nell'altro carbonio adiacente al gruppo che contiene la funzione carbossilica e quindi forma un isomero, che per le condizioni di reazione risulta essere minoritario.
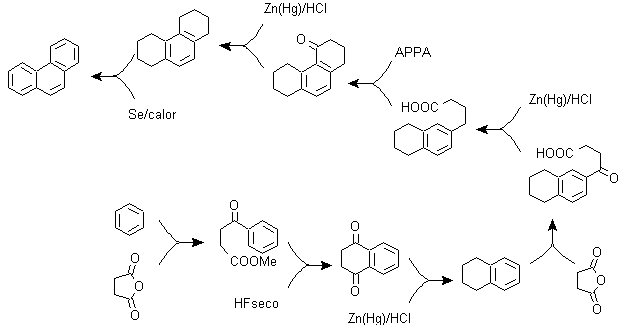
Metodo A :
I materiali di partenza sono generalmente naftalene e anidride succinica. Per garantire che la reazione di acilazione con l'anidride avvenga al carbonio 2 (beta) del naftalene, è necessario condurre la reazione a una temperatura superiore a 60 ºC.
A temperatura ambiente, la posizione di acilazione sarà il carbonio 1 (alfa), il che dà luogo a una variante del metodo, che però sono essenzialmente le stesse reazioni che si verificano e c'è anche la formazione di un altro isomero molto meno significativo che nel primo caso. Pertanto, è preferibilmente utilizzato come reazione ufficiale per la preparazione del fenantrene con il metodo Howorth.
Metodo B :
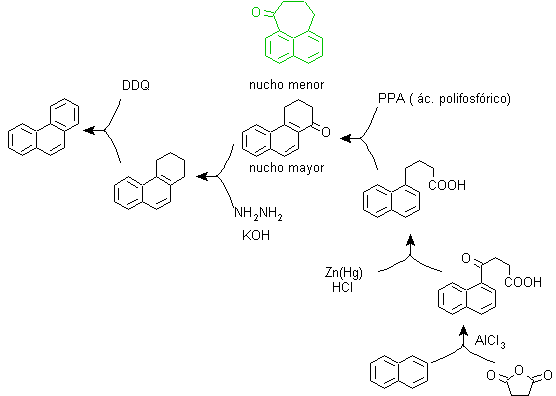
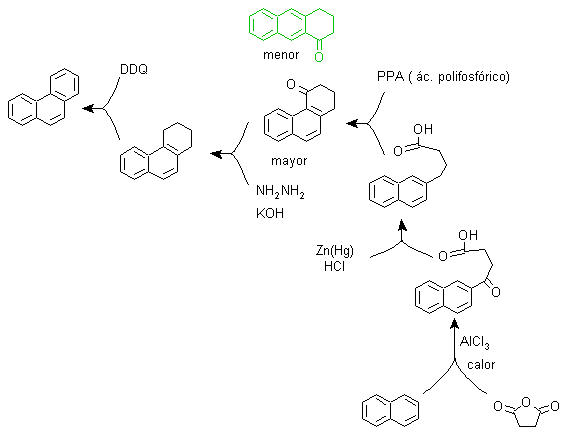
B) Sintesi Bardhan-Sengupta (1932).
In questa sintesi la strategia passa attraverso la costruzione o "assemblaggio" del ciclo intermedio che viene poi ridotto (aromatizzato) dal selenio metallico e dal calore, la ciclizzazione viene effettuata dalla reazione di un alcool, su un anello benzenico, catalizzata da anidride fosforica , che allo stesso tempo estrae gli idrogeni dal cicloesanolo. La ciclizzazione risulta essere regiospecifica, non viene effettuata dalla tradizionale alchilazione di Friedel-Crafts, motivo per cui non si verifica la formazione di altri isomeri.
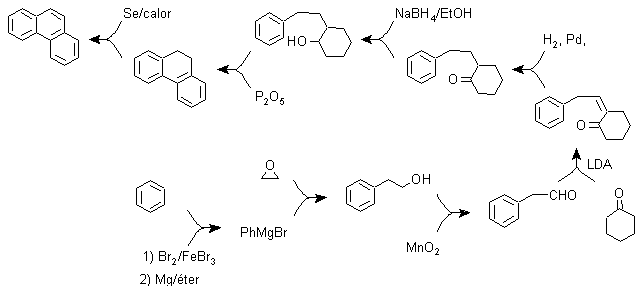
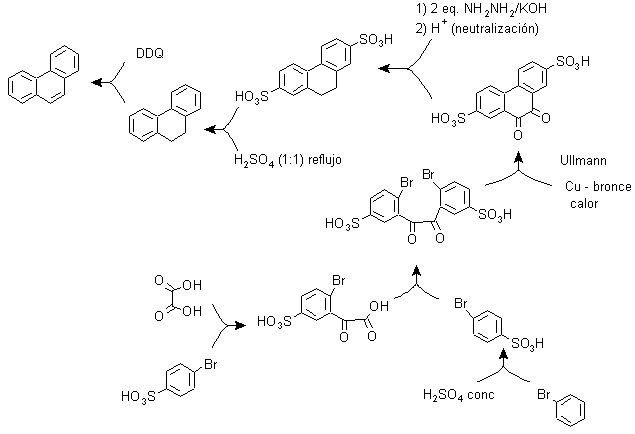
C) Sintesi, basata sulla strategia della reazione di Ullman .
I gruppi arilici possono essere accoppiati con buone rese secondo la reazione di Ullman e alcune sue varianti. Nella sintesi che viene proposta di seguito, il ciclo interno è formato da un accoppiamento di due benzeni che hanno nella loro struttura un sostituente alogeno (bromo). L'aromatizzazione di questo ciclo viene effettuata attraverso l'azione di un chinone disostituito come il DDQ.
A causa di questa strategia, un gruppo si trova in posizione para, al bromobenzene, che deve occupare temporaneamente tale posizione e la cui rimozione dall'anello benzenico è successivamente relativamente facile, cosa che avviene con il gruppo solfonico.
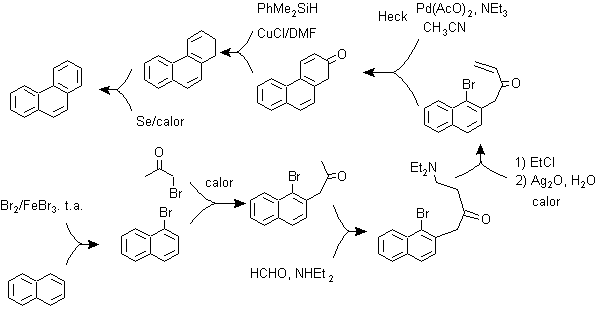
D) Sintesi, basata sulla strategia di reazione di Heck
L'accoppiamento dagli alogenuri aromatici agli alcheni, per l'azione catalitica del Pd o dei suoi sali, può essere un'altra delle reazioni utilizzate in una strategia di sintesi, per poliarili fusi.
E) Sintesi, basata sulla strategia di reazione di MacMurry
La riduzione bimolecolare di aldeidi e chetoni, catalizzata da sali di Ti(III) o Ti(IV), nota come reazione di MacMurry, può essere utilizzata anche in una strategia per la sintesi di composti policiclici condensati, come il fenantrene e come si può vedere sotto:
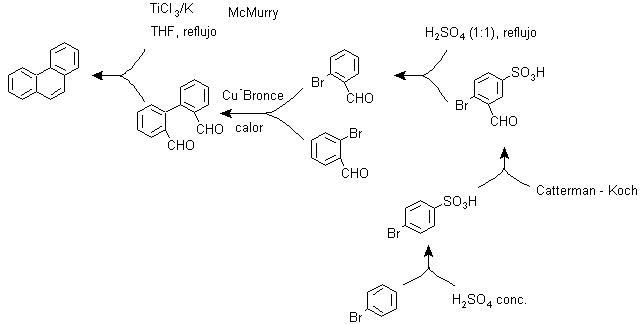
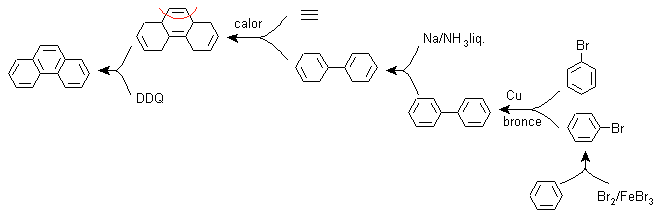
F) Sintesi, basata sulla strategia della reazione di Diels-Alder
La funzionalizzazione del fenantrene a composto triciclico non aromatico permette la formazione di una molecola precursore di tipo addotto, dove si intravede la struttura del diene e del dienofilo, che permette di applicare la disconnessione relativa alla reazione di Diels-Alder . Questa molecola precursore può essere ottenuta attraverso la riduzione della betulla del bifenile.
Il bifenile è il risultato della reazione di accoppiamento di due moli di bromobenzene, secondo Ullman.
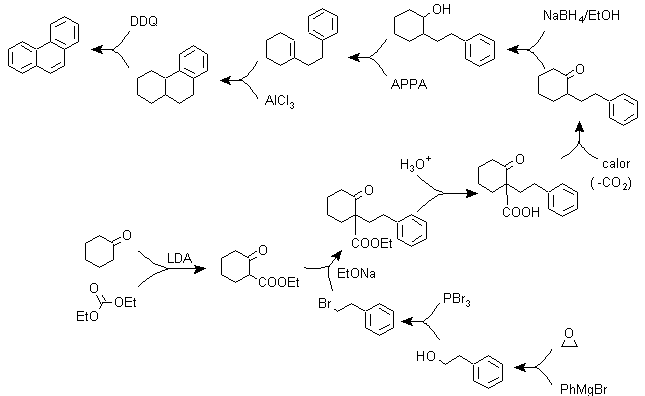
B) Varianti della sintesi basate su acilazioni e alchilazioni di Friedel-Crafts .
Sintesi che non richiedono particolari commenti, perché le reazioni utilizzate sono abbondantemente note.
g1.
g2.
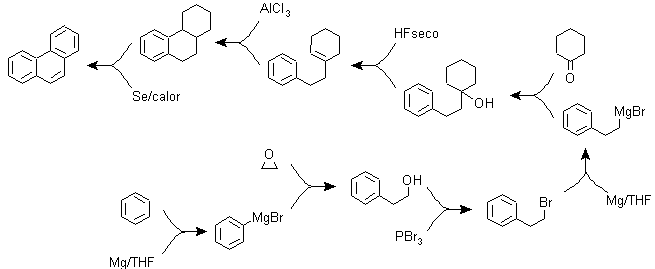
g3.
g4.