Phenanthren-Synthese
(Synthesebaum-Methode)
Phenanthren ist ein polyzyklischer aromatischer Kohlenwasserstoff, der drei kondensierte Benzolringe enthält, weshalb es ein Isomer von Anthracen ist.
| entweder |
|
Die traditionellen Syntheseverfahren von Phenanthren, die die Bildung von Zyklen und deren anschließende "Aromatisierung" beinhalten, sind mit den von Haworth und Bardhan-Sengupta (1932) vorgeschlagenen verbunden, wie unten zu sehen sein wird.
Es ist auch möglich, andere neue Methoden für Phenanthren und allgemein für polycyclische aromatische Verbindungen vorzuschlagen, basierend auf der entsprechenden Verwendung der Ullman-Kupplungsreaktionen, der Heck-Reaktion, der Suzuki-Reaktion und der MacMurry-Reaktion, sowie der Varianten und Erweiterungen, die diese Reaktionen darstellen.
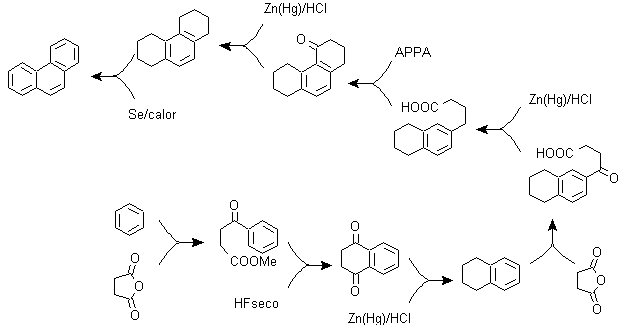
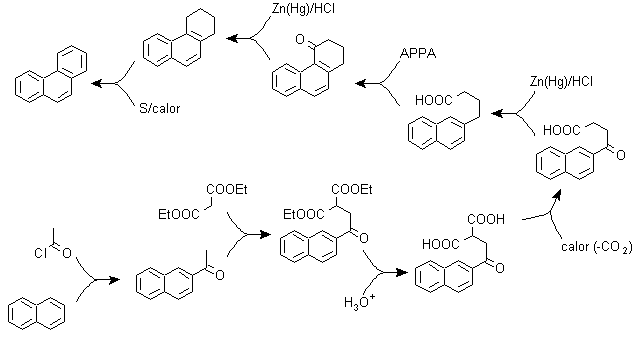
Zu) Haworths Synthese:
Dieses Verfahren basiert auf der Friedel-Crafts-Acylierungsreaktion und hat den Nachteil, dass die abschließende Cyclisierung zum Bilden des dritten an Naphthalin ankondensierten Rings nicht selektiv ist, da es auch möglich ist, dass der Verschluss in dem anderen Kohlenstoff neben der Gruppe stattfindet, die es enthält die Carboxylfunktion und bildet somit ein Isomer, das sich aufgrund der Reaktionsbedingungen als in der Minderzahl herausstellt.
Methode A :
Die Ausgangsmaterialien sind üblicherweise Naphthalin und Bernsteinsäureanhydrid. Um sicherzustellen, dass die Acylierungsreaktion mit dem Anhydrid am Kohlenstoff 2 (beta) von Naphthalin stattfindet, muss die Reaktion bei einer Temperatur von über 60 °C durchgeführt werden.
Bei Raumtemperatur ist die Acylierungsposition Kohlenstoff 1 (Alpha), was zu einer Variante des Verfahrens führt, die jedoch im Wesentlichen die gleichen Reaktionen sind, die auftreten, und es gibt auch die Bildung eines anderen Isomers, das viel weniger signifikant ist als im ersten Fall. Daher wird es vorzugsweise als offizielle Reaktion zur Herstellung von Phenanthren nach der Howorth-Methode verwendet.
Methode B :
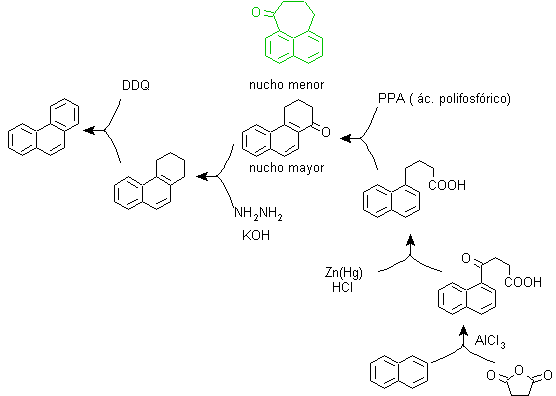
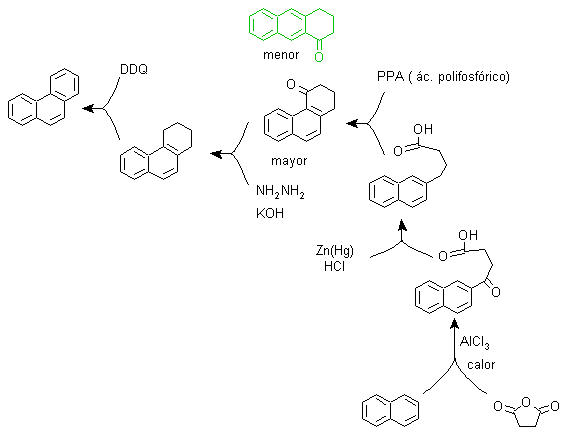
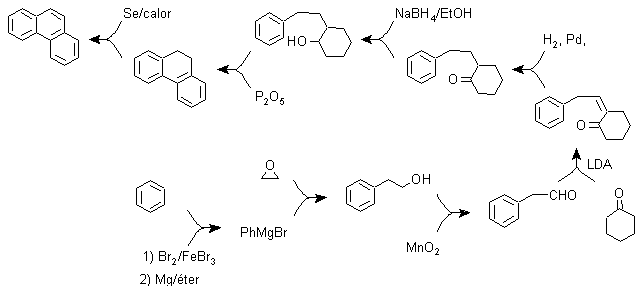
B) Bardhan-Sengupta-Synthese (1932).
Bei dieser Synthese geht die Strategie über den Aufbau oder „Zusammenbau“ des Zwischenzyklus, der dann durch metallisches Selen und Wärme reduziert (aromatisiert) wird, die Cyclisierung wird durch die Reaktion eines Alkohols an einem Benzolring durchgeführt, katalysiert durch Phosphorpentoxid , das gleichzeitig die Wasserstoffe von Cyclohexanol abstrahiert. Die Cyclisierung erweist sich als regiospezifisch, sie erfolgt nicht durch die traditionelle Friedel-Crafts-Alkylierung, weshalb die Bildung anderer Isomere nicht auftritt.
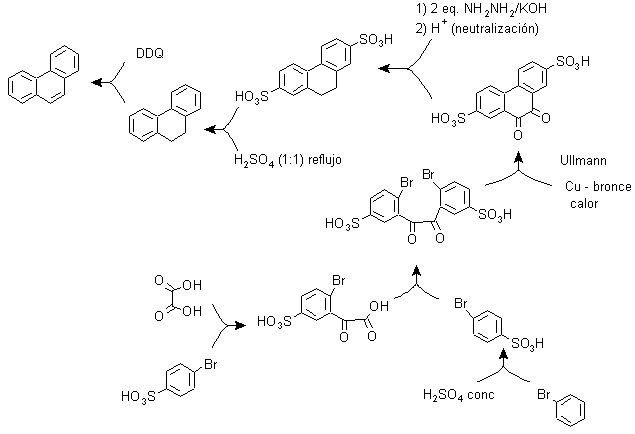
C) Synthese, basierend auf der Strategie der Ullman-Reaktion .
Arylgruppen können mit guten Ausbeuten nach der Ullman-Reaktion und einigen ihrer Varianten gekuppelt werden. In der unten vorgeschlagenen Synthese wird der interne Zyklus durch eine Kupplung von zwei Benzolen gebildet, die einen Halogen-(Brom-)Substituenten in ihrer Struktur aufweisen. Die Aromatisierung dieses Zyklus wird durch die Wirkung eines disubstituierten Chinons wie DDQ durchgeführt.
Durch diese Strategie befindet sich in para-Position zum Brombenzol eine Gruppe, die diese Position vorübergehend besetzen muss und deren Abspaltung vom Benzolring später relativ einfach ist, was bei der Sulfonsäuregruppe der Fall ist.
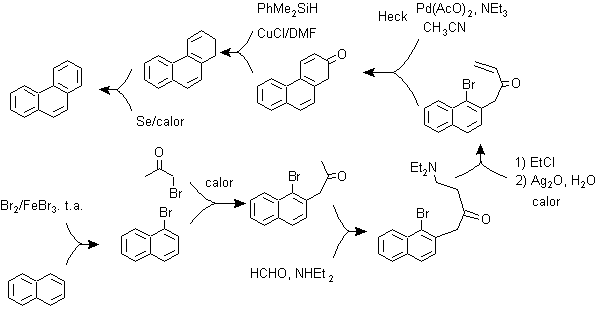
D) Synthese, basierend auf der Heck-Reaktionsstrategie
Die Kupplung von aromatischen Halogeniden zu Alkenen, aufgrund der katalytischen Wirkung von Pd oder seinen Salzen, kann eine weitere der Reaktionen sein, die in einer Synthesestrategie für kondensierte Polyaryle verwendet werden.
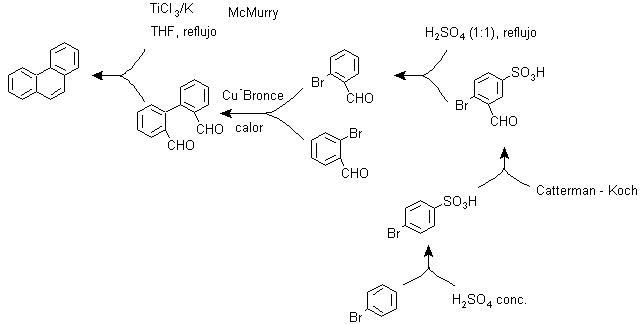
Und) Synthese, basierend auf der MacMurry-Reaktionsstrategie
Die bimolekulare Reduktion von Aldehyden und Ketonen, katalysiert durch Ti(III)- oder Ti(IV)-Salze, bekannt als MacMurry-Reaktion, kann auch in einer Strategie zur Synthese von kondensierten polycyclischen Verbindungen wie Phenanthren und wie ersichtlich verwendet werden unter:
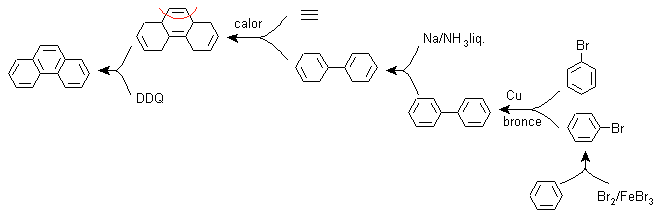
F) Synthese, basierend auf der Strategie der Diels-Alder-Reaktion
Die Funktionalisierung von Phenanthren zu einer nichtaromatischen tricyclischen Verbindung ermöglicht die Bildung eines Vorläufermoleküls vom Addukttyp, bei dem die Struktur des Diens und des Dienophils flüchtig zu sehen ist, wodurch die mit der Diels-Alder-Reaktion verbundene Trennung angewendet werden kann . Dieses Vorläufermolekül kann durch die Birch-Reduktion von Biphenyl erhalten werden.
Biphenyl ist laut Ullman das Ergebnis der Kupplungsreaktion von zwei Mol Brombenzol.
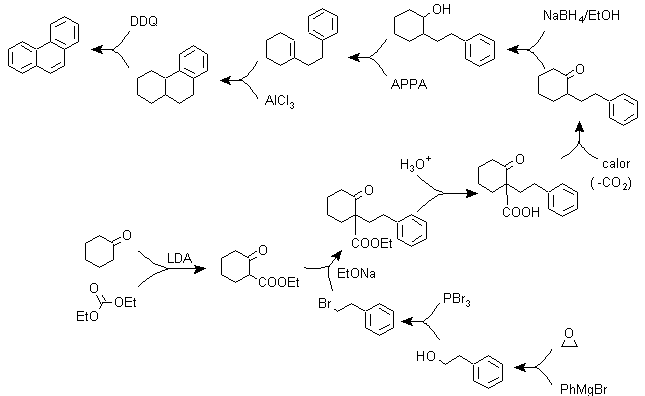
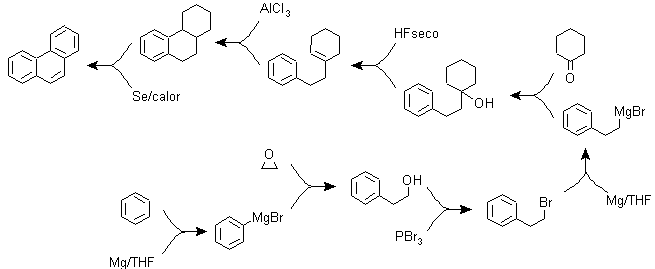
B) Varianten der Synthese auf Basis von Friedel-Crafts-Acylierungen und -Alkylierungen .
Synthesen, die keiner besonderen Erläuterung bedürfen, da die verwendeten Reaktionen hinreichend bekannt sind.
g1.
g2.
g3.
g4.