Synthèse de phénanthrène
(Méthode de l'arbre de synthèse)
Le phénanthrène est un hydrocarbure aromatique polycyclique, qui contient trois cycles benzéniques condensés, c'est pourquoi il est un isomère de l'anthracène.
|
|
soit |
|
Les méthodes de synthèse traditionnelles du phénanthrène, celles qui impliquent la formation de cycles et leur "aromatisation" ultérieure, sont liées à celles proposées par Haworth et Bardhan - Sengupta (1932), comme on le verra ci-dessous.
Il est également possible de proposer d'autres méthodes nouvelles, pour le Phénanthrène et en général pour les composés aromatiques polycycliques, sur la base de l'utilisation appropriée des réactions de couplage d'Ullman, de la réaction de Heck, de la réaction de Suzuki et de la réaction de MacMurry, ainsi que de la variantes et extensions qui présentent ces réactions.
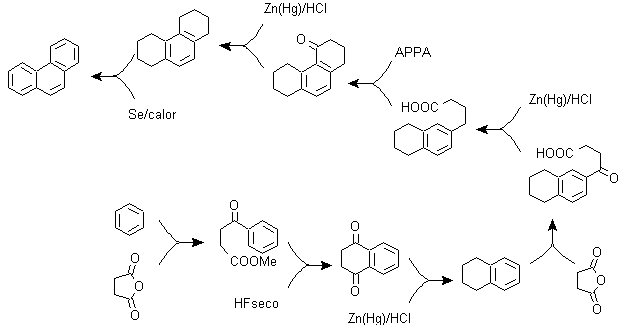
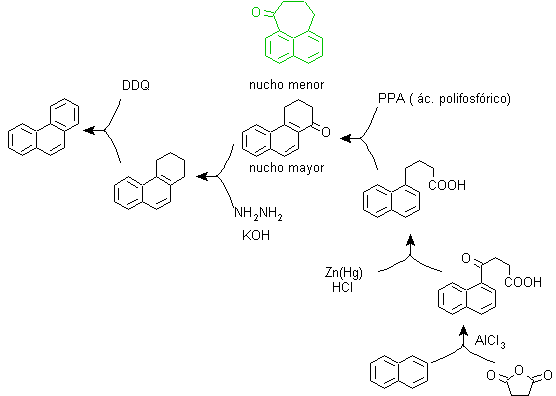
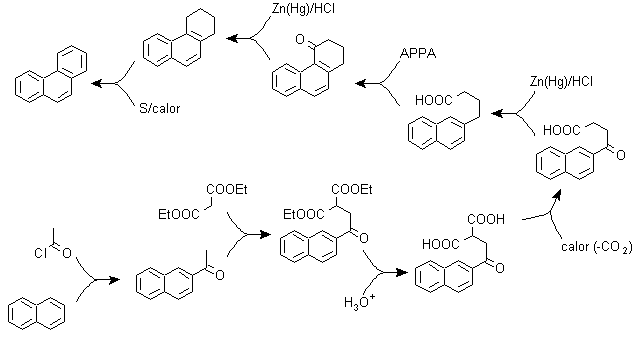
pour) La synthèse de Haworth :
Cette méthode est basée sur la réaction d'acylation de Friedel-Crafts et présente l'inconvénient que la cyclisation finale pour former le troisième cycle fusionné au naphtalène n'est pas sélective, car il est également possible que la fermeture se produise dans l'autre carbone adjacent au groupe qui contient la fonction carboxylique et forme ainsi un isomère, qui du fait des conditions réactionnelles s'avère minoritaire.
Méthode A :
Les matières premières sont généralement le naphtalène et l'anhydride succinique. Pour s'assurer que la réaction d'acylation avec l'anhydride se produit au niveau du carbone 2 (bêta) du naphtalène, il est nécessaire d'effectuer la réaction à une température supérieure à 60 ºC.
A température ambiante, la position d'acylation sera le carbone 1 (alpha), ce qui donne lieu à une variante de la méthode, qui, cependant, sont essentiellement les mêmes réactions qui se produisent et il y a aussi la formation d'un autre isomère qui est beaucoup moins important que dans le premier cas. Par conséquent, il est de préférence utilisé comme réaction officielle pour la préparation du phénanthrène par la méthode Howorth.
Méthode B :
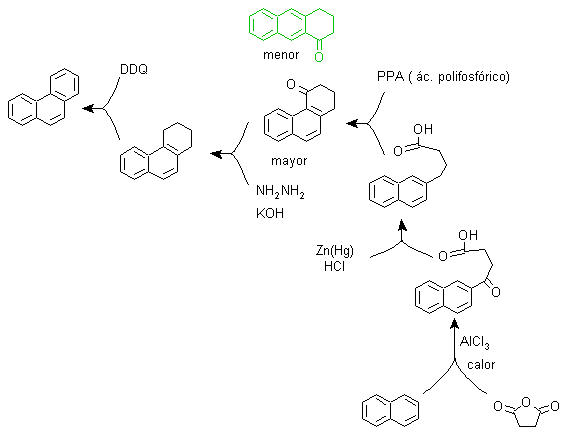
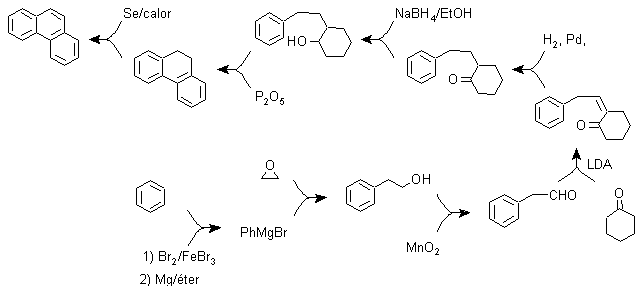
b) Synthèse Bardhan-Sengupta (1932).
Dans cette synthèse, la stratégie passe par la construction ou "l'assemblage" du cycle intermédiaire qui est ensuite réduit (aromatisé) par le sélénium métallique et la chaleur, la cyclisation est réalisée par la réaction d'un alcool, sur un cycle benzénique, catalysée par le pentoxyde de phosphore , qui en même temps extrait les hydrogènes du cyclohexanol. La cyclisation s'avère être régiospécifique, elle n'est pas réalisée par l'alkylation Friedel-Crafts traditionnelle, c'est pourquoi la formation d'autres isomères ne se produit pas.
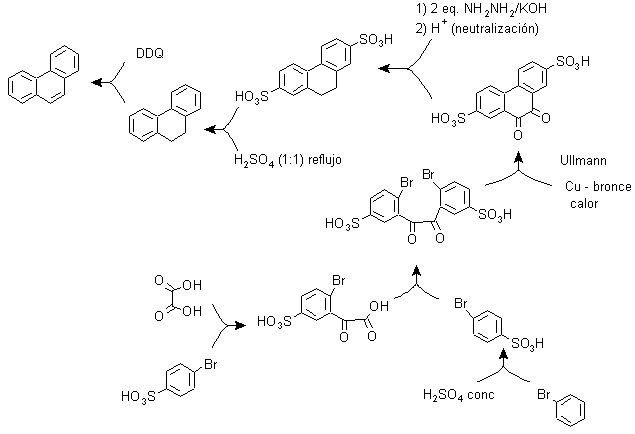
c) Synthèse, basée sur la stratégie de la réaction d'Ullman .
Les groupements aryles peuvent être couplés avec de bons rendements selon la réaction d'Ullman et certaines de ses variantes. Dans la synthèse proposée ci-dessous, le cycle interne est formé par un couplage de deux benzènes ayant un substituant halogène (brome) dans leur structure. L'aromatisation de ce cycle est réalisée par l'action d'une quinone disubstituée telle que la DDQ.
Du fait de cette stratégie, un groupe se situe en position para, du bromo benzène, qui doit temporairement occuper ladite position et dont l'élimination du cycle benzénique est ensuite relativement aisée, ce qui se produit avec le groupe sulfonique.
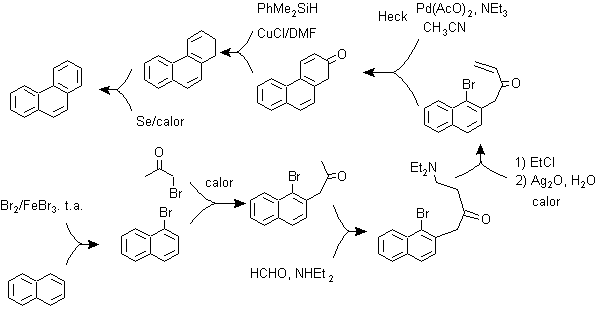
d) Synthèse, basée sur la stratégie de réaction de Heck
Le couplage des halogénures aromatiques aux alcènes, du fait de l'action catalytique du Pd ou de ses sels, peut être une autre des réactions utilisées dans une stratégie de synthèse, pour les polyaryles condensés.
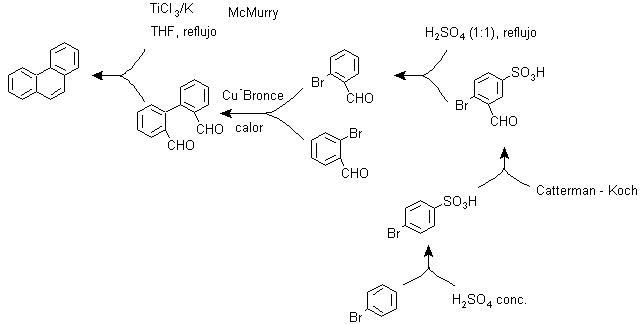
et) Synthèse, basée sur la stratégie de réaction de MacMurry
La réduction bimoléculaire des aldéhydes et des cétones, catalysée par les sels de Ti(III) ou de Ti(IV), dite réaction de MacMurry, peut également être utilisée dans une stratégie de synthèse de composés polycycliques condensés, comme le Phénanthrène et comme on peut le voir dessous:
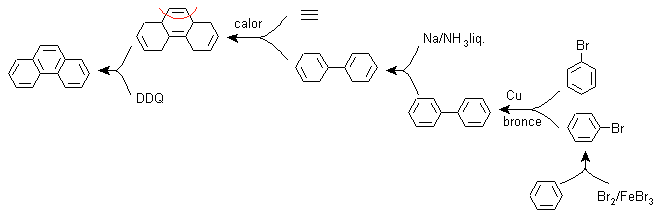
F) Synthèse, basée sur la stratégie de la réaction de Diels-Alder
La fonctionnalisation du phénanthrène en un composé tricyclique non aromatique permet la formation d'une molécule précurseur de type adduit, où l'on entrevoit la structure du diène et du diénophile, ce qui permet d'appliquer la déconnexion liée à la réaction de Diels-Alder . Cette molécule précurseur peut être obtenue par la réduction Birch du biphényle.
Le biphényle est le résultat de la réaction de couplage de deux moles de bromobenzène, selon Ullman.
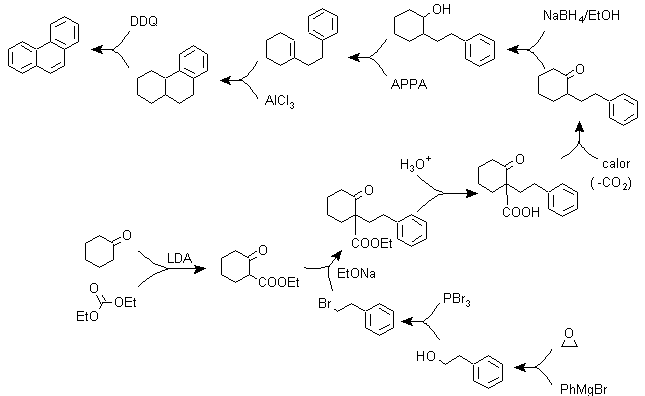
b) Variantes de la synthèse basées sur les acylations et alkylations de Friedel-Crafts .
Des synthèses qui n'appellent pas de commentaires particuliers, car les réactions utilisées sont abondamment connues.
g1.
g2.
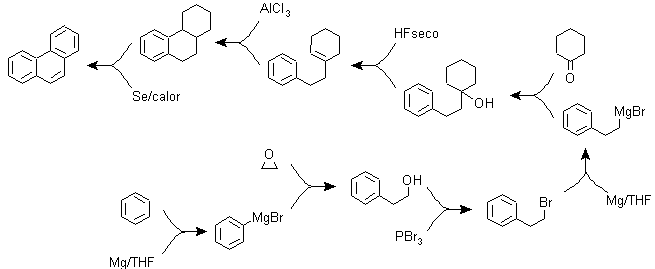
g3.
g4.