Les composés 1,5-dioxygénés sont généralement le résultat de réactions d'addition conjuguées de nucléophiles à partir de composés carbonylés, avec des H α acides (énols, énolates, énamines, etc.), ainsi que des nitriles et des nitrates, sur des substrats alpha bêta insaturés en ce qui concerne à des groupes carbonyle et similaires, connus sous le nom de réaction de Michael, avec des options complémentaires étant la réaction Nef et la réaction d'annulation (annulation) de Robinson.
Déconnecter modèle 1, 5 dioxygène (1,5-diO)
Le modèle de déconnexion 1,5-diO peut être appliqué, après la fonctionnalisation nécessaire, à des composés tels que : 1,5-dihydroxyles, 1,5-hydroxyaldéhydes, 1,5-hydroxycétones, 1,5-hydroxyesters, 1,5- cétoaldéhydes, 1,5-dicétones, 1,5-cétoesters, 1,5-dialdéhydes, etc.
Les possibilités augmentent si l'on prend également en compte les dérivés nitrés et les nitriles qui peuvent former des carbanions très réactifs en milieu basique capables de s'additionner à des composés carbonylés α ,β-insaturés pour obtenir des produits de type 1,5-diO.
L' analyse fondamentale de la déconnexion des composés 1,5-diO est la suivante :
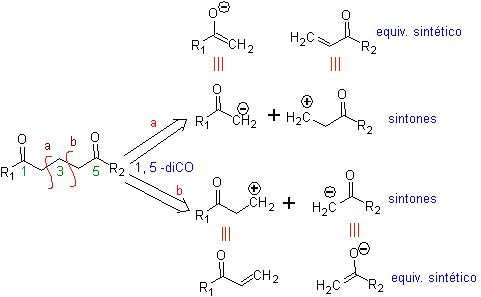
Le choix de la déconnexion (a) ou (b), autour de C3, dépendra de la nature des groupements R1 et R2, qui pourra conférer une stabilité plus ou moins grande au synthon ou équivalent synthétique nécessaire à la formation de
Proposer un design de synthèse pour MOb 29, 30 et
|
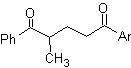
Mob 29
|
|
Mob 30
|
|
Mob 31
|
Solution:
MOb 29 . Analyse rétrosynthétique : Le carbanion nécessaire à ajouter au composé a , b -insaturé CO Il peut être obtenu à partir de malonate de diéthyle en milieu basique. Ce qui forcera par la suite une décarboxylation, pour atteindre
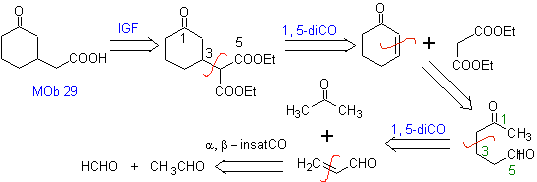
MOb 30
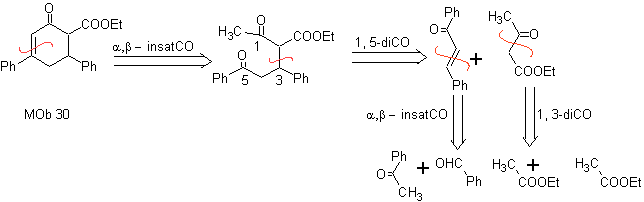
. Analyse rétrosynthétique. Elle commence par la déconnexion par la double liaison de
30 et continue avec les
relations d'ions dicarbonyle qui se forment.
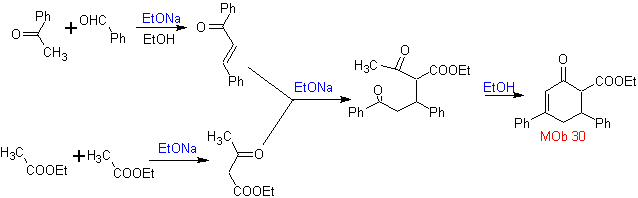
La synthèse. Il procède par une combinaison de Condensations de Claisen, Claisen Schmidt , la réaction de Michael et l'annulation de Robinson, pour arriver à
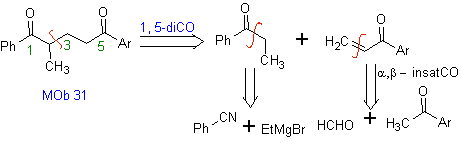
Les vinylcétones sont très réactives et ont tendance à se dimériser par la réaction de Diels-Alder, c'est pourquoi, si elles sont nécessaires comme substrat dans la réaction d'addition de Michael, il faut les préparer "in situ" et une réaction très utile pour cela est la réaction de Mannich, comme on peut le voir dans l'exemple suivant.
MOb 32 . Analyse rétrosynthétique. L'application initiale du modèle de déconnexion 1,5-diCO génère un précurseur tel que la vinylcétone, qui doit être formé par la réaction de Mannich, suivie d'une élimination de Hoffmann, pour se combiner avec le cétoester formé par la condensation de Claisen.
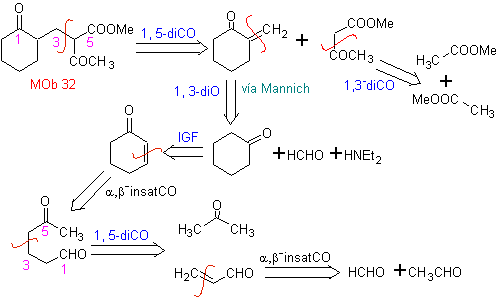
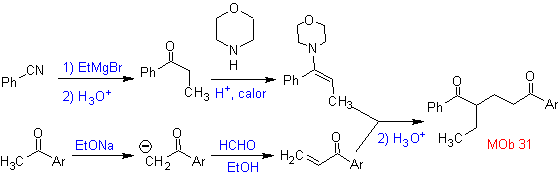
La synthèse. La vinylcétone nécessaire à la réaction de (Michael) avec le cétoester est préparée en combinant convenablement la réaction de Mannich et l'élimination d'Hoffmann.
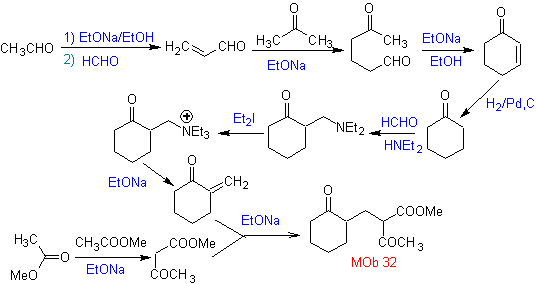
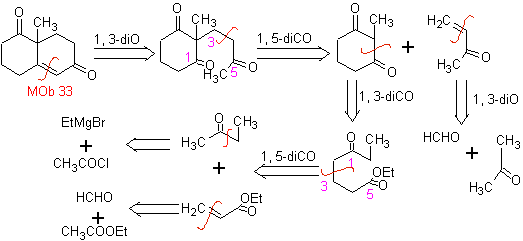
La synthèse. Il faudra exercer un contrôle, générer le nucléophile avec le C 2º, ce qui est réalisé par la formation de l'énamine, avec un groupe amino suffisamment volumineux. Le produit est formé comme indiqué par l'annulation ou l'annulation Robinson.
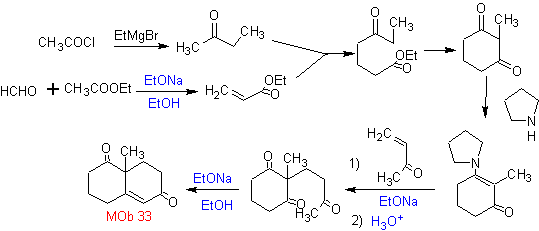
L'annelation de Robinson permet également d'obtenir des composés 1,3-dicétones cycliques.
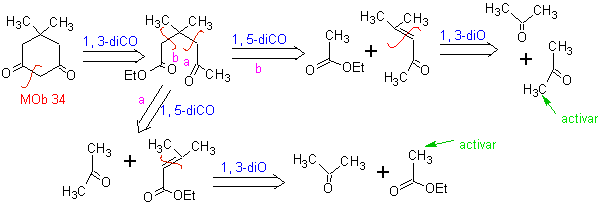
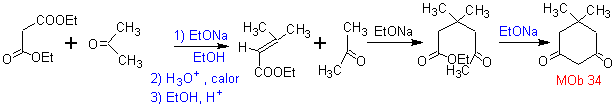
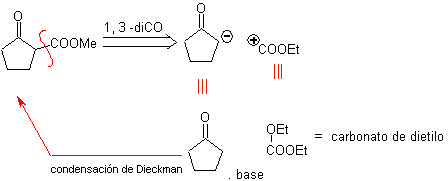
MOb 34. Analyse rétrosynthétique. La déconnexion du 1,3-diCO de