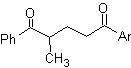
I composti 1,5-diossigenati sono generalmente il risultato di reazioni di addizione coniugata di nucleofili da composti carbonilici, con H α acidi (enoli, enolati, enammine, ecc.), nonché nitrili e nitrati, su substrati alfa beta insaturi rispetto a gruppi carbonilici e simili, nota come reazione di Michael, con opzioni complementari essendo la reazione di Nef e la reazione di annullamento (annulazione) di Robinson.
Disconnettere modello 1, 5 diossigeno (1,5-diO)
Il modello di disconnessione 1,5-diO può essere applicato, dopo la necessaria funzionalizzazione, a composti quali: 1,5-diidrossili, 1,5-idrossialdeidi, 1,5-idrossichetoni, 1,5-idrossiesteri, 1,5- chetoaldeidi, 1,5-dichetoni, 1,5-chetoesteri, 1,5-dialdeidi, ecc.
Le possibilità aumentano se si prendono in considerazione anche nitroderivati e nitrili, che possono formare carbanioni molto reattivi in un mezzo basico in grado di addizionarsi a composti carbonilici α,β-insaturi per ottenere prodotti di tipo 1,5-diO.
L' analisi fondamentale della disconnessione dei composti 1,5-diO è la seguente:
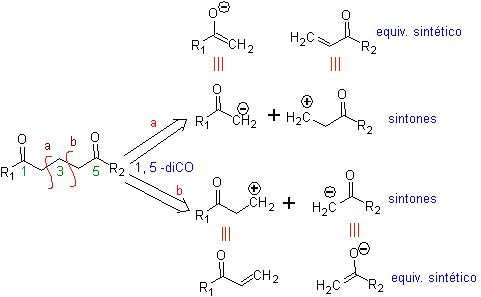
La scelta della disconnessione (a) o (b), attorno a C3, dipenderà dalla natura dei gruppi R1 e R2, che possono conferire maggiore o minore stabilità al sintone o equivalente sintetico necessario per la formazione di
Proporre un progetto di sintesi per MOb 29, 30 e
MOb 29
| MOb 30
| MOb 31
|
Soluzione:
MOb 29 . Analisi retrosintetica: il carbanione doveva essere aggiunto al composto a , b -insaturo CO Può essere ottenuto da dietil malonato in un terreno basico. Che successivamente forzerà una decarbossilazione, da raggiungere
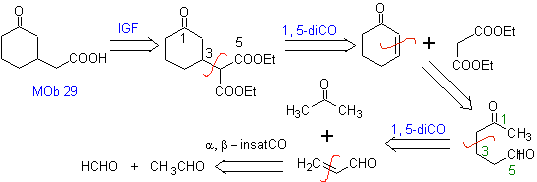
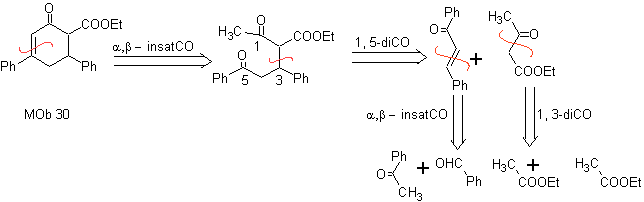
Sintesi. Si procede con una combinazione di Condensazioni di Claisen, Claisen Schmidt , la reazione di Michael e l'annullamento di Robinson, per arrivare a
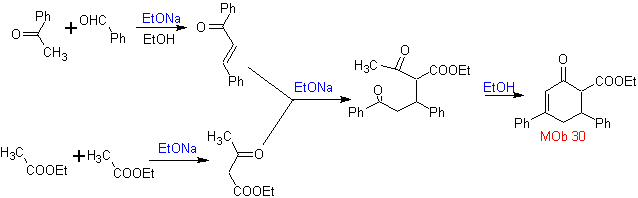
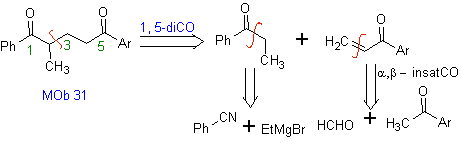
I vinilchetoni sono molto reattivi e tendono a dimerizzare per reazione di Diels-Alder, motivo per cui, se sono necessari come substrato nella reazione di addizione di Michael, è necessario prepararli "in situ" e una reazione molto utile per questo è la reazione di Mannich, come si può vedere nell'esempio seguente.
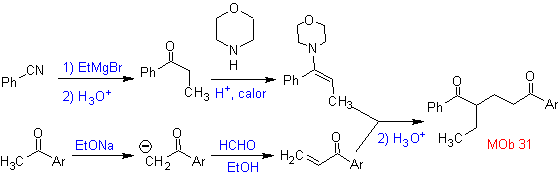
MOb 32 . Analisi retrosintetica. L'applicazione iniziale del modello di disconnessione 1,5-diCO genera un precursore come il vinilchetone, che deve essere formato dalla reazione di Mannich, seguita dall'eliminazione di Hoffmann, per combinarsi con il chetoestere formato dalla condensazione di Claisen.
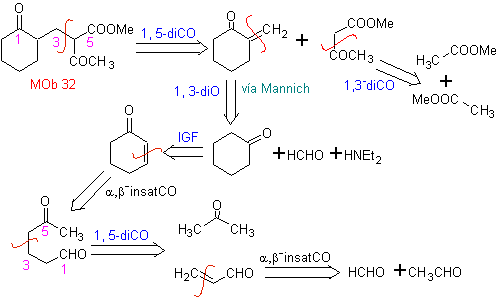
Sintesi. Il vinilchetone necessario alla reazione (di Michael) con il chetoestere viene preparato combinando opportunamente la reazione di Mannich e l'eliminazione di Hoffmann.
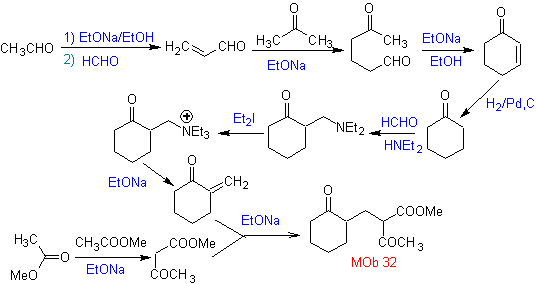
Sintesi. Sarà necessario esercitare il controllo, per generare il nucleofilo con il C 2º, che si ottiene con la formazione dell'enamina, con un gruppo amminico sufficientemente voluminoso. Il prodotto è formato come indicato dall'annullamento o dall'annullamento Robinson.
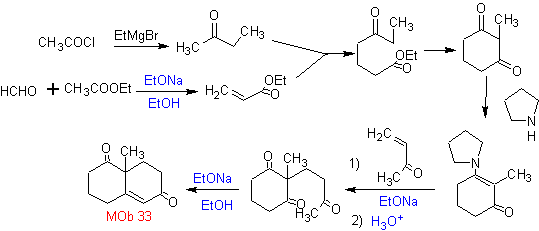
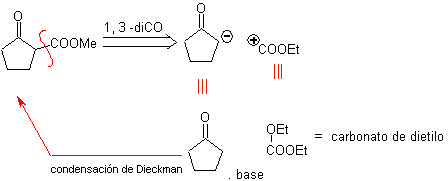
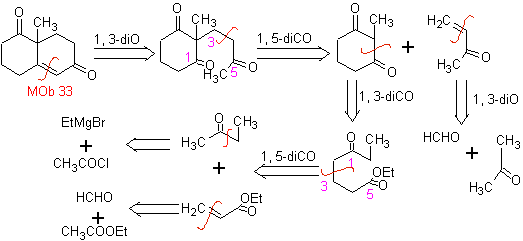
L'annelazione di Robinson consente anche di ottenere composti 1,3-dichetonici ciclici.
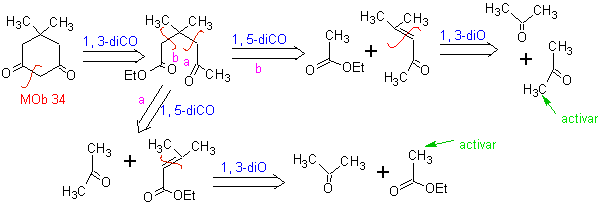
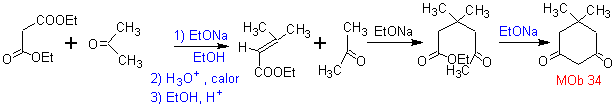
MOb 34. Analisi retrosintetica. La disconnessione 1,3-diCO di