Les modèles suivants montrent la structure, les distances et les angles de liaison de l'éthène. Chacun des carbones de la molécule est $sp^2$ hybridé. Sa géométrie est plate, avec des angles de liaison proches de 120º.
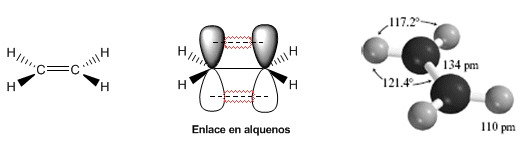
La double liaison est formée par une liaison $\sigma$ qui est obtenue par le chevauchement des orbitales hybrides $sp^2$, et une liaison $\pi$ formée par le chevauchement des orbitales p qui ne se sont pas hybridées (orbitales p pures ).
La double liaison est plus forte et plus courte que la simple. L'énergie de la double liaison dans l'éthène est de 605 KJ/mol contre 368 KJ/mol pour la simple liaison carbone-carbone dans l'éthane.







