Le contrôle en synthèse organique est l'une des tâches les plus importantes pour réaliser la transformation requise ou planifiée. et/ou pour éviter la formation de ces sous-produits qui entravent considérablement le développement optimal de la synthèse organique en question. De même, d'un point de vue plus général, le contrôle peut également inclure ou couvrir les aspects de symétrie et de sélectivité.
Ensuite, le contrôle doit être compris comme une série d'opérations de synthèse qui permettent au chimiste de former le squelette carboné avec la fonctionnalité voulue ou de "placer" un groupe ou un atome à la place ou à la position requise.
Par conséquent, ces opérations peuvent être d'une gamme variée de routines avec une intention reflétée par le chimiste et qui exigent certaines capacités cognitives et compétences similaires à celles artistiques, pour la construction (synthèse) de molécules organiques.
Par conséquent, dans les réactions de condensation, comme dans d'autres, les opérations de contrôle peuvent être incluses dans l'une des catégories suivantes.
![]() Réactions concurrentes (auto-condensation et/ou condensation croisée)
Réactions concurrentes (auto-condensation et/ou condensation croisée)
![]() Activation – désactivation
Activation – désactivation
![]() Sélectivité et spécificité
Sélectivité et spécificité
![]() Protection-déprotection
Protection-déprotection
Dans les réactions de condensation des composés carbonylés, il est essentiel d'établir à l'avance l'ordre des événements pour minimiser ou, si nécessaire, supprimer les possibilités d'auto-condensation et l'apparition de condensation croisée, qui sont malheureusement une menace évidente dans ces réactions. .
auto condensation
Tous les composés carbonyle qui ont un ou plusieurs hydrogènes alpha, sur les carbones adjacents au groupe carbonyle, courent le risque de subir une réaction d'auto-condensation si la rigueur correspondante n'est pas suivie.
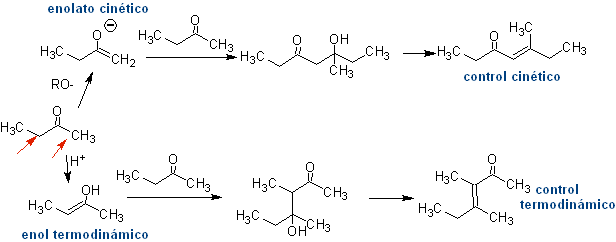
Ainsi, par exemple, si une base non hydroxylée telle que EtONa est ajoutée à une 2-butanone, il se formera un énolate qui pourra éventuellement se combiner avec une autre molécule de la même cétone. De même, si H+ est ajouté, une auto-condensation peut également se produire, comme on peut le voir dans le schéma suivant : cela peut être minimisé en ajoutant à la même vitesse, à partir de dispositifs d'alimentation séparés, la base ou l'acide au composé qui fournira l'énol ou l'énolate et le composé carbonyle qui sera attaqué sur le carbone carbonyle . Un ballon tricol et une agitation magnétique peuvent être utilisés.
v\:* {comportement:url(#default#VML);} o\:* {comportement:url(#default#VML);} w\:* {comportement:url(#default#VML);} .shape {behavior:url(#default#VML);} Normal 0 21 faux faux faux MicrosoftInternetExplorer4
/* Définitions de style */ table.MsoNormalTable { mso-style-name:"Normal Table" ; mso-tstyle-rowband-size:0 ; mso-tstyle-colband-size:0 ; mso-style-noshow : oui ; mso-style-parent : "" ; mso-rembourrage-alt:0cm 5.4pt 0cm 5.4pt; mso-pour-marge : 0 cm ; mso-pour-marge-bas :.0001pt ; mso-pagination:veuve-orpheline; taille de police : 10,0 pt ; font-family:"Times New Roman" ; mso-ansi-language:#0400 ; mso-fareast-language:#0400; mso-bidi-language:#0400;}
condensation croisée
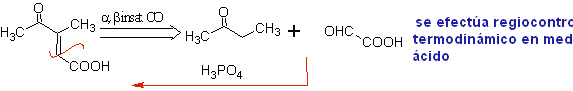
Idéalement, dans les réactions de condensation de composés carbonylés, l'une des molécules réactives devrait s'énoliser rapidement, tandis que l'autre devrait de préférence ne pas avoir de Hα. , pour s'assurer qu'aucun autre sous-produit ne se forme
La rétrosynthèse qui est analysée ci-dessous est un bon exemple de ce qui a été indiqué précédemment.
v\:* {comportement:url(#default#VML);} o\:* {comportement:url(#default#VML);} w\:* {comportement:url(#default#VML);} .shape {comportement:url(#default#VML);}
Normal 0 21 faux faux faux Microsoft Internet Explorer 4
st1\:*{behavior:url(#ieooui) }
/* Définitions de style */ table.MsoNormalTable { mso-style-name:"Normal Table" ; mso-tstyle-rowband-size:0 ; mso-tstyle-colband-size:0 ; mso-style-noshow : oui ; mso-style-parent : "" ; mso-rembourrage-alt:0cm 5.4pt 0cm 5.4pt; mso-pour-marge : 0 cm ; mso-pour-marge-bas :.0001pt ; mso-pagination:veuve-orpheline; taille de police : 10,0 pt ; font-family:"Times New Roman" ; mso-ansi-language:#0400 ; mso-fareast-language:#0400; mso-bidi-language:#0400;}
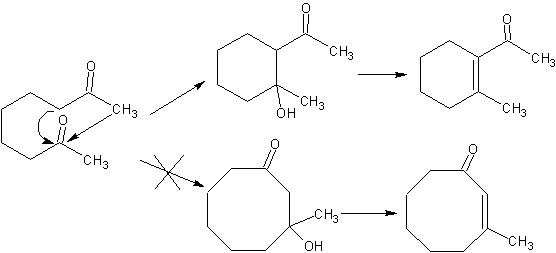
Condensation intramoléculaire .
Lorsqu'il y a deux groupes fonctionnels dans une molécule qui affectent directement les carbones alpha par rapport au carbonyle, il est fort probable qu'il y ait une auto-condensation intramoléculaire et les cycles qui se forment doivent avoir une stabilité élevée, comme c'est le cas des anneaux de cinq et six maillons. Les anneaux avec un plus grand nombre de maillons difonctionnalisés (7, 8 etc.), ne sont pas des produits probables en raison de la labilité de ces cycles.
Utilisation de la réaction de Mannich.
Dans les réactions d'addition conjuguée sur substrats carbonyles alpha, bêta-insaturés (α, β-inssatCO), caractéristiques de la réaction de Michael, la nécessité d'utiliser des vinylcétones apparaît. Mais lorsqu'on essaie de le préparer à partir de la condensation de la cétone et du formaldéhyde, il se forme d'autres produits de polymérisation de l'aldéhyde qui rendent sa préparation difficile.
La réaction de Mannich permet d'obtenir des vinylcétones lors de la synthèse et au moment nécessaire, ce qui par ailleurs présente de sérieuses difficultés dans sa préparation. Cet aspect est illustré dans la synthèse du MOb 25
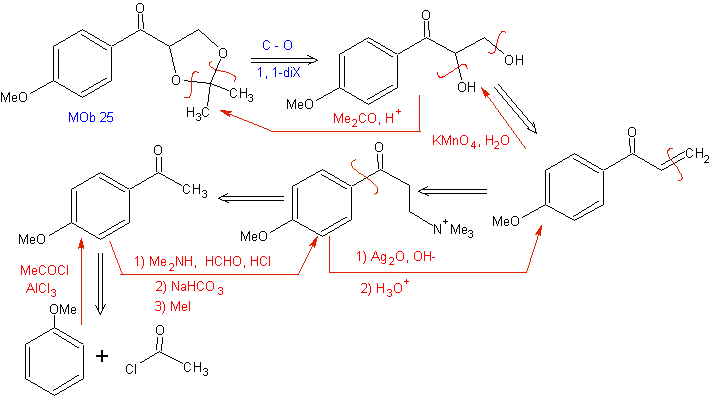
Activation des groupes
Système non activé :
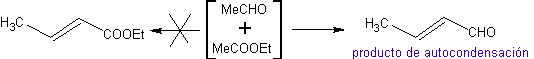
système activé
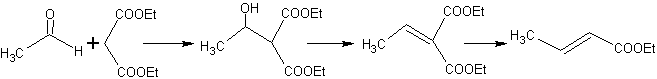
¨ énamines
Il a déjà été dit qu'un moyen d'avoir un énolate activé est la formation d'une énamine, entre le composé carbonylé et une amine secondaire. Cet aspect est illustré dans l'exemple de synthèse suivant.
Analyse rétrosynthétique : Dans la synthèse de MOb 26, on observe le bon usage des énamines pour garantir la formation du composé 1,3 diCO.
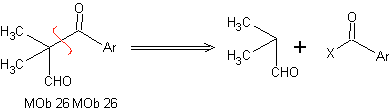
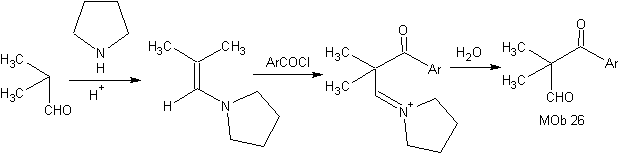
Synthèse : L'énamine formée, permet son acylation respective, pour atteindre le Mob26
¨ réduction de bouleau
Cette réduction constitue une bonne alternative pour préparer des cyclohexénones, comme on peut le voir dans la synthèse de MOb 27 :
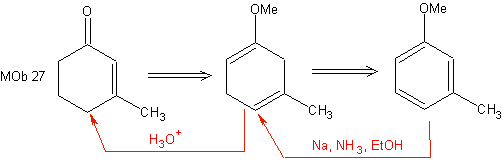
Cependant, il convient de rappeler que certains composés α, β -carbonyle insaturé, peut également être préparé par la réaction de Wittig et par la réaction de Reformatsky.
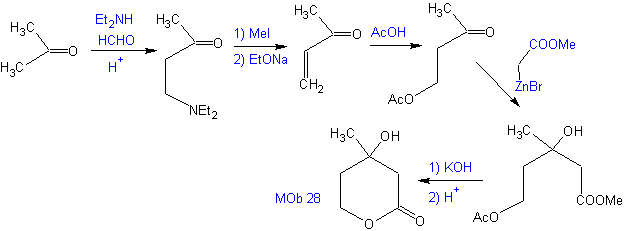
Proposer un plan de synthèse, à partir de matériaux simples pour MOb 28.
Analyse rétrosynthétique : Initialement, la lactone est déconnectée, suivie d'une déconnexion sous la forme d'un motif 1,3-diO. Le composé carbonyle α,β-insaturé (α,β-insat. CO) généré aurait pu être obtenu par l'élimination d'Hoffmann et la cétoamine, par la réaction de Mannich
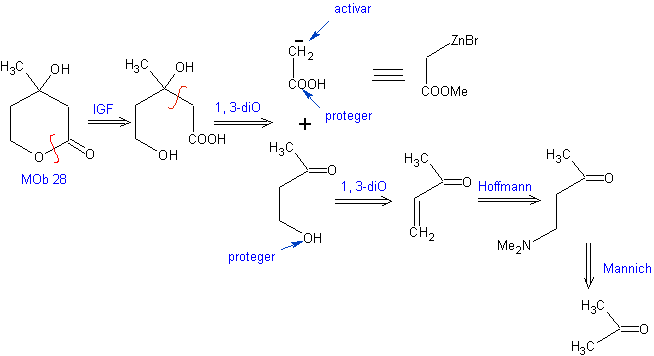
Synthèse : La synthèse de Mob 28, est tout à fait approprié pour montrer le contrôle qu'il faut exercer sur certains centres réactionnels pour accomplir les transformations désirées et nécessaires.