Estereoquímica y análisis conformacional
La Estereoquímica es la rama de la química que se ocupa de los aspectos tridimensionales de las moléculas y de su reactividad. No se puede entender la Química Orgánica sin tener en cuenta la Estereoquímica. Los sistemas biológicos son muy selectivos y a menudo discriminan moléculas con diferencias estereoquímicas muy pequeñas.
El análisis conformacional forma parte del estudio espacial de las moléculas, esto es, de la Estereoquímica.
CONSTITUCIÓN, CONFIGURACIÓN Y CONFORMACIÓN
Se denominan isómeros a compuestos con la misma fórmula
empírica pero diferente estructura.
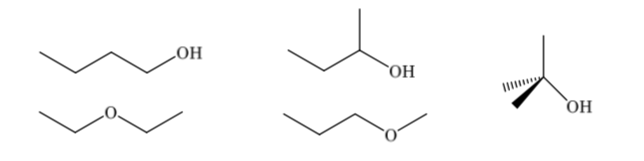
Los isómeros constitucionales difieren en su secuencia de enlace, presentan diferente conectividad. Un compuesto de fórmula molecular C4H10O puede presentar diferentes constituciones:
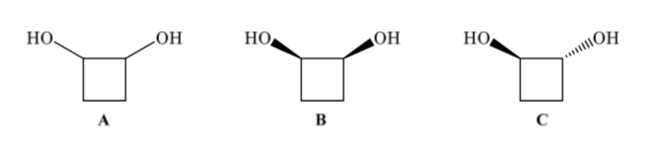
Los isómeros configuracionales tienen la misma conectividad pero difieren en la disposición espacial de los átomos. El 1,2-ciclobutanodiol (A) puede presentar dos isómeros configuracionales según si los dos grupos OH están hacia el mismo lado (B) o lados opuestos (C)
Los Isómeros conformacionales tienen la misma constitución, igual configuración, pero difieren espacialmente en que se pasa de un isómero a otro por simple rotación de un enlace. Las diversas formas que adquieren las moléculas como resultado de la rotación en torno a un enlace sencillo, se llaman conformaciones y cada una de ellas constituye un confórmero.
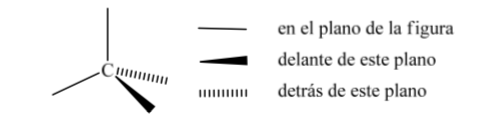
Una de las representaciones más utilizadas del carbono tetraédrico es la llamada representación en perspectiva.
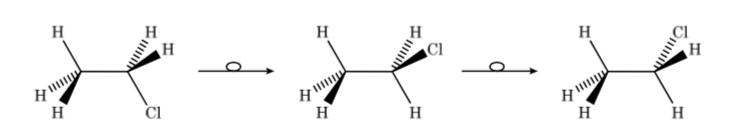
Así, en el caso del cloroetano podemos representar los distintos confórmeros en perspectiva de la forma siguiente:
Los isómeros configuracionales y los conformacionales sonestereoisómeros. Los estereoisómeros tienen la misma conectividad pero difieren en la orientación de alguno de sus átomos en el espacio. Presentan a menudo diferencias considerables en sus propiedades físicas, químicas y biológicas.
CONFORMACIÓN EN MOLÉCULAS ORGÁNICAS ACÍCLICAS
Representación de las moléculas orgánicas
Existen diversas formas de representar en el plano las moléculas.
Representación en Perspectiva o Caballete
Proyección de Newman
En una proyección de Newman se representan dos átomos de carbono contiguos en una molécula dentro de un círculo. En la parte delantera se sitúa el átomo de carbono que se ve de frente y por detrás del círculo el átomo de carbono solapado. Del centro de círculo salen por delante y por detrás los tres sustituyentes de cada carbono
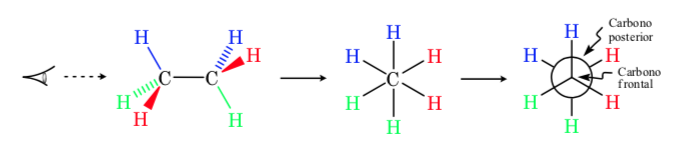
Representación de Fischer
En la representación de Fischer un átomo de carbono tetraédrico se encuentra representado por el centro de una cruz y los sustituyentes se colocan en los extremos de forma que los trazos verticales indican que los enlaces van dirigidos hacia atrás del plano del papel y los horizontales hacia delante. La cadena principal se dispone de forma vertical.
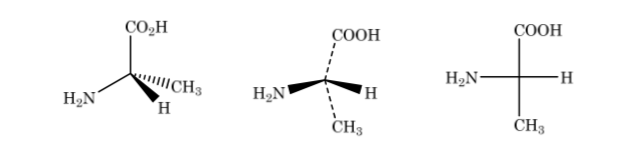
Como se muestra anteriormente la representacion del ácido 2-aminopropanoico
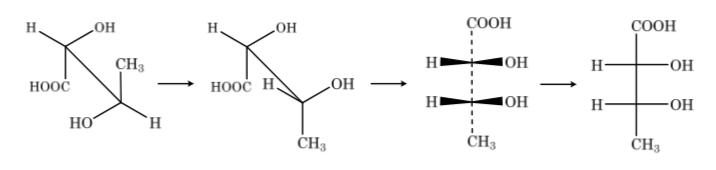
Si el compuesto presenta diferentes átomos de carbono, la cadena carbonada se dibuja en vertical con los sustituyentes de cada carbono en horizontal manteniendo siempre la norma de que los enlaces verticales van hacia detrás del plano y los horizontales hacia delante.
Conformaciones del Etano
El enlace σ que une los átomos de carbono en el etano es cilíndricamente simétrico y permite la libre rotación alrededor del mismo. La rotación alrededor del enlace C–C interconvierte las diferentes conformaciones del etano. El estudio de su comportamiento termodinámico y cinético se denomina Análisis Conformacional.
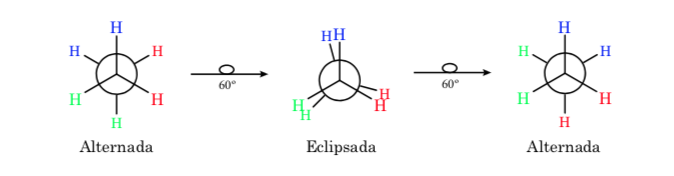
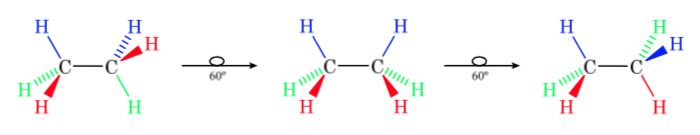
La primera figura representa a la molécula de etano donde los átomos de hidrógeno se encuentran lo más alejados posible con una interacción mínima entre ellos. Se denomina conformación alternada.
La segunda proviene de haber realizado un giro de 60o al enlace C–C y donde los átomos de hidrógeno se encuentran de forma eclipsada.
De nuevo un giro de 60o al enlace C–C nos conduce a una conformación alternada.
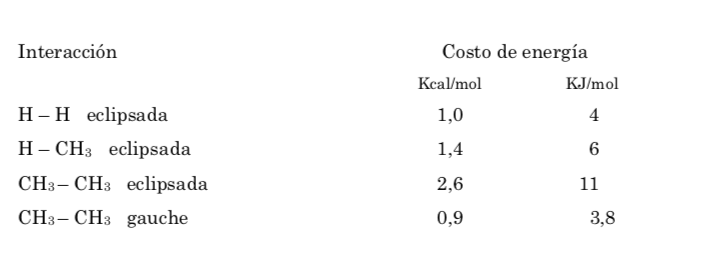
La energía potencial de la molécula es mínima para la conformación alternada, va aumentando con la rotación y alcanza un máximo con la conformación eclipsada. La diferencia energética o barrera de energía a superar para pasar de una conformación a otra es del orden de 3 kcal (ver dibujo).
La mayoría de las moléculas de etano existen naturalmente en la conformación más estable. Como la barrera de energía no es muy alta a temperatura ambiente el número de colisiones con energía suficiente es bastante grande de modo que la interconversión de confórmeros es rápida. La energía requerida para rotar la molécula en torno al enlace C–C se debe a la tensión torsional.
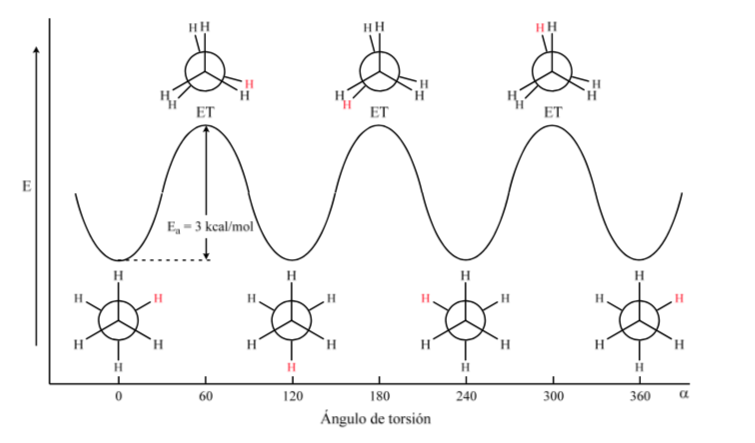
El diagrama anterior representa los cambios de energía al pasar de una conformación a otra durante la rotación del enlace simple C–C.
Cuando se reemplazan los hidrógenos del etano por otros átomos o grupos irán cambiando los niveles energéticos de las conformaciones y su estudio habrá de realizarse para cada caso.
Conformaciones del propano
En el caso de la molécula de propano si representamos las proyecciones de Newman según uno de los enlace C – C y vamos rotando el enlace nos encontramos al igual que en el caso del etano con conformaciones eclipsadas y alternadas.
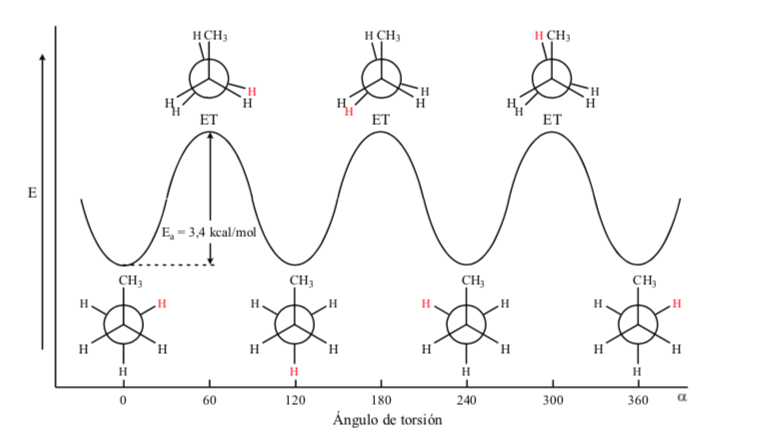
La barrera de energía entre una forma alternada y una eclipsada es mayor que en el caso del etano (3,4 kcal mol-1) ya que el grupo metilo es más grande que el hidrógeno y las interacciones son mayores. Las conformaciones alternadas son más estables que las eclipsadas.
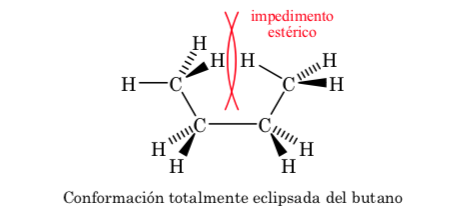
Conformaciones del n-Butano
Si nos fijamos en el enlace central C–C podremos considerar al butano a la hora de representarlo en Newman como una molécula similar a la de etano en la que se han reemplazado dos átomos de hidrógeno por dos grupos metilo.
Al igual que en el etano las conformaciones alternadas tienen menor energía y son más estables que las eclipsadas: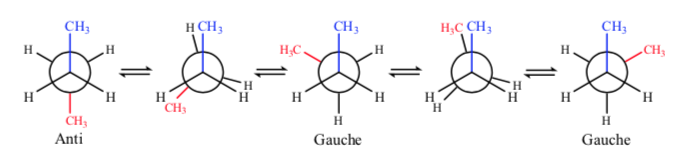
De todas las conformaciones alternadas aquella que tiene los dos grupos metilo en posición lo más opuesto posible (ángulo diedro 180o) se denomina conformación anti y es la más estable. Las otras dos conformaciones alternadas son de energía similar entre ellas y se denominan conformaciones gauche donde los grupos metilo se encuentran formando un ángulo diedro de 60o uno de otro. Existen dos conformaciones de este tipo según la rotación alrededor del enlace C–C.
De las tres conformaciones eclipsadas destacamos en primer lugar aquella donde se encuentran eclipsados los dos grupos metilo que genera mayor interacción y por tanto menor estabilidad. Las otras dos conformaciones eclipsadas presentan menor contenido energético y son algo más estables. Ver el diagrama energético.
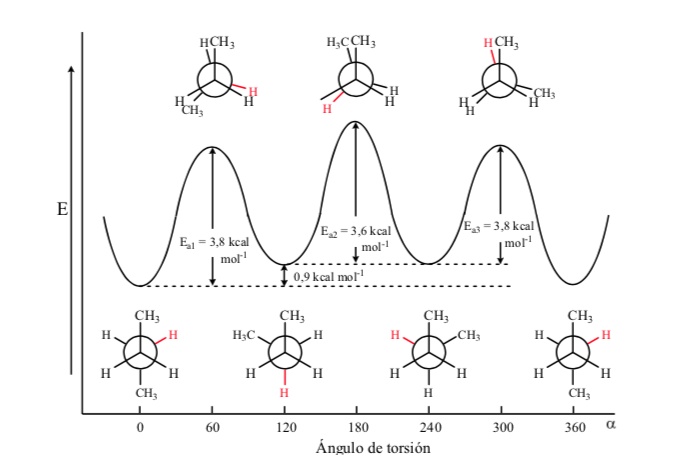
Las colisiones proporcionan la energía necesaria para superar la barrera de la energía de activación.
CONFORMACIÓN EN MOLÉCULAS ORGÁNICAS CÍCLICAS
Los cicloalcanos están sometidos a una tensión de anillo llamada Tensión de Bayer debido a la estructura cíclica que presentan. Dicha tensión es el resultado de tres factores:
- Tensión de Enlace
- Eclipsamiento de átomos y enlaces- Tensión Estérica
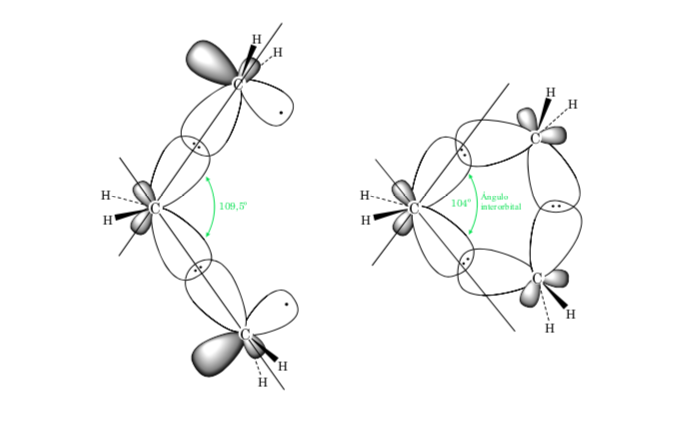
A. La Tensión de Enlace en cicloalcanos es debida a la diferencia en el solapamiento de los orbitales respecto a un alcano acíclico. Cuanto más cercano es el valor del ángulo C–C–C al tetraédrico (109,5o) mayor será el solapamiento y menor la tensión de enlace.
El efecto estérico se debe a la interacción de los átomos a través del espacio. Para evitar que la interacción entre los átomos sea elevada, la molécula adquiere una conformación preferente, esto es la más estable. Para reducir las tensiones y conseguir así estabilidad, la conformación preferente será aquella en la que los grupos voluminosos se alejan lo más posible unos de otros.
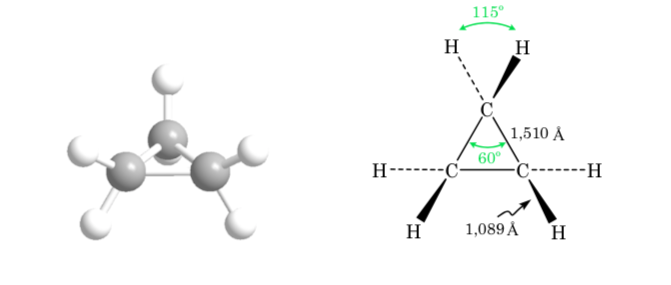
CONFORMACIÓN EN CICLOS DE TRES, CUATRO Y CINCO ÁTOMOS DE CARBONO
Ciclopropano
La desviación del ángulo de enlace del anillo de tres miembros respecto al ángulo correspondiente a una hibridación sp3 es grande, por lo que el ciclopropano presenta una tensión angular muy alta.
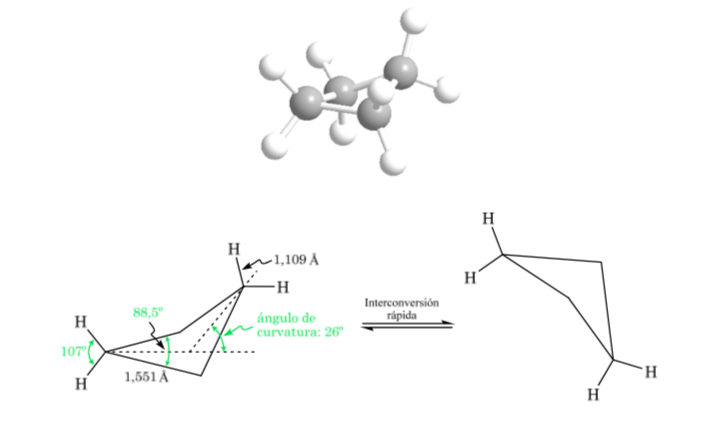
Ciclobutano: Conformación mariposa
La molécula presenta una estructura ligeramente alabeada. Los enlaces C–C están menos curvados y su reactividad es menor que en el caso del ciclopropano. La interconversión entre las distintas conformaciones es rápida.
Ciclopentano: Conformación sobre
El ciclopentano si fuera plano presentaría una tensión por eclipsamiento alta, debido a diez interacciones H–H eclipsadas por lo que se produce un plegamiento en el anillo. El plegamiento libera tensión torsional. El ciclopentano no presenta la reactividad de los anillos de tres y cuatro miembros.
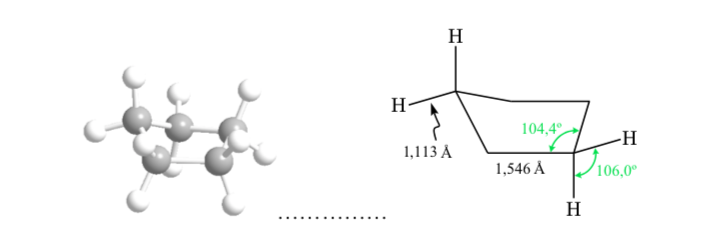
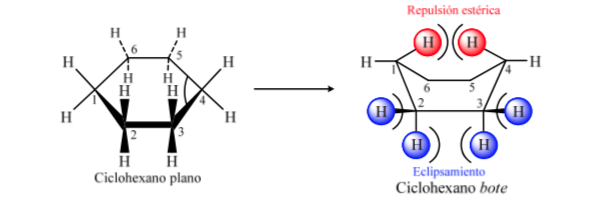
ANÁLISIS CONFORMACIONAL DE CICLOHEXANOS : Conformación silla
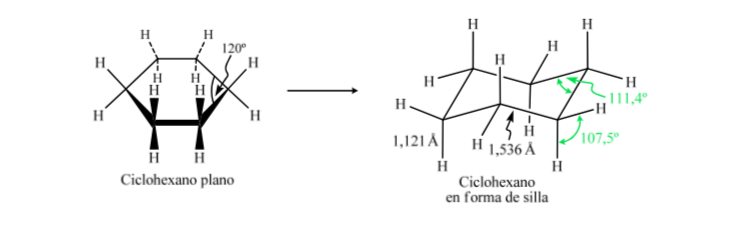
Si el ciclohexano presentara una estructura plana le correspondería un ángulo de enlace de 120o. Un carbono con hibridación sp3 y sin tensión presenta un ángulo tetraédrico de 109,5o, lo que hace que el ciclohexano adquiera una conformación no plana y más estable: Conformación silla.
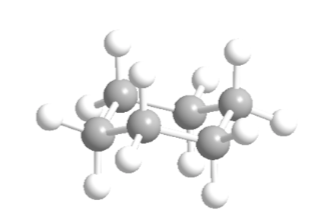
El ciclohexano en conformación silla presenta 6 átomos de hidrógeno axiales y 6 hidrógenos ecuatoriales. Los hidrógenos axiales están dirigidos hacia arriba y hacia abajo del anillo, mientras que los hidrógenos ecuatoriales se dirigen hacia fuera del anillo.
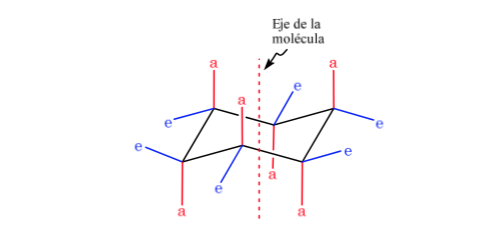
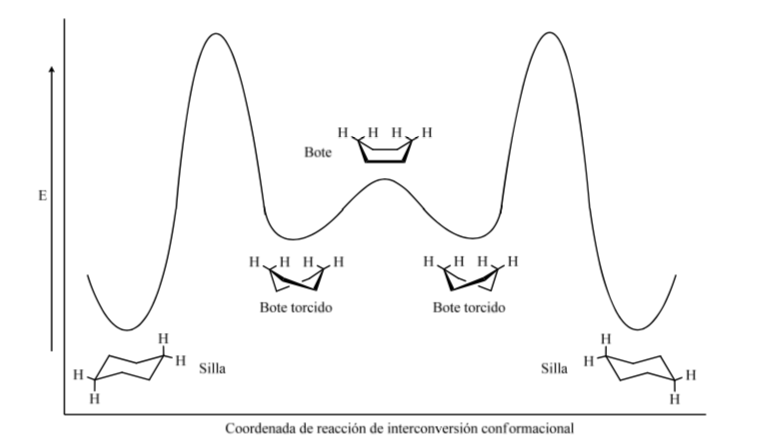
El ciclohexano en conformación silla es susceptible de modificar su conformación por otra silla de igual estabilidad. A este fenómeno se le denomina interconversión de dos formas silla.
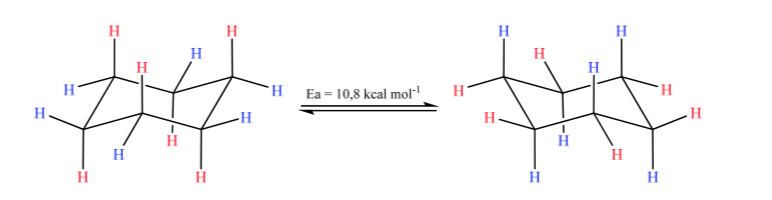
Fijándose detenidamente en la interconversión se observa que el enlace C–H axial pasa a ser ecuatorial y viceversa, el ecuatorial pasa a ser axial.
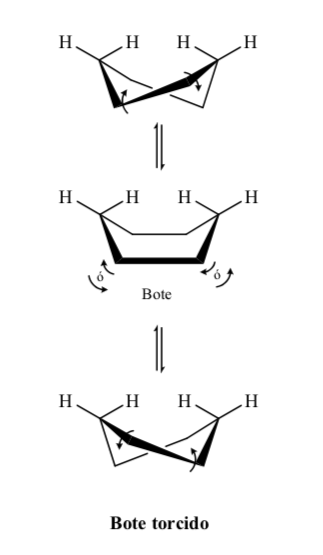
Niveles energéticos de los confórmeros del ciclohexano:
Si observamos una conformación silla del ciclohexano de forma que el átomo C-2 solapa al C-3 y el átomo C-6 solapa al C-5 podemos dibujar una proyección de Newman del ciclohexano:
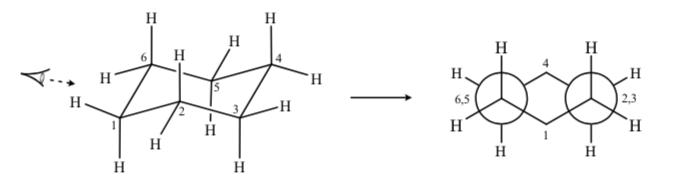
CICLOHEXANOS SUSTITUIDOS
Si consideramos el metilciclohexano podemos proponer dos estructuras que lo representen según si el grupo metilo se encuentra en posición axial o ecuatorial.
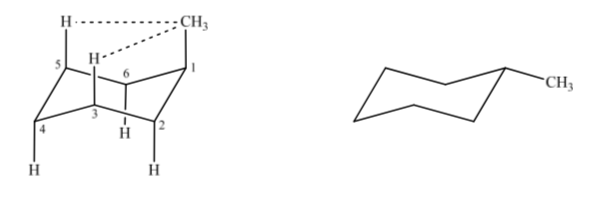
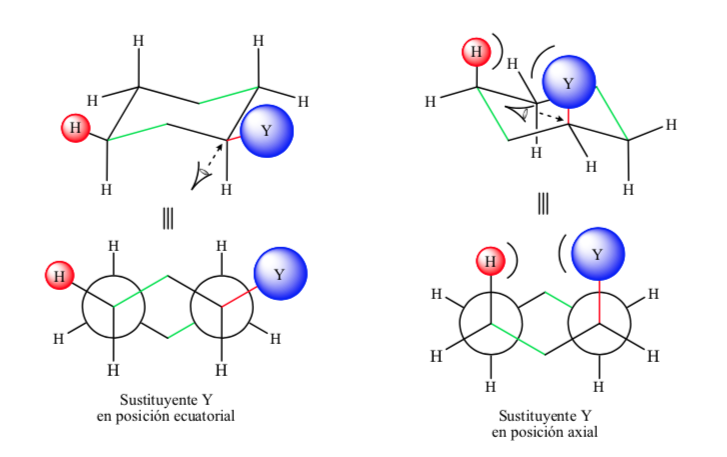
Si el sustituyente diferente al hidrógeno se encuentra en posición axial se producen interacciones con los hidrógenos en posición 3 y 5 del anillo por proximidad espacial. Si se encuentra en posición ecuatorial el sustituyente va dirigido hacia fuera del anillo y las interacciones son menores. Tal como era de esperar se encuentra que la conformación con el sustituyente en ecuatorial es alrededor de 1,8 kcal más estable que si el sustituyente se encuentra en posición axial. Así se dice que un sustituyente en posición axial presenta una interacción 1,3-diaxial que lo hace menos estable que en posición ecuatorial.
En la siguiente figura se representan el Newman las dos conformaciones de un ciclohexano sustituido tanto con el sustituyente en posición ecuatorial como en axial.
Ciclohexanos disustituidos
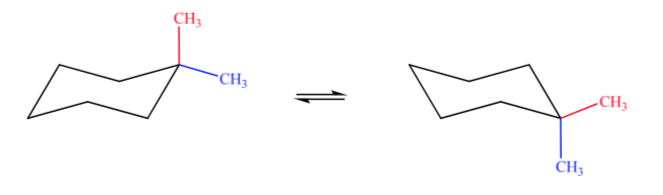
A. 1,1-dimetilciclohexano B. 1,2-dimetilciclohexano C. 1,3-dimetilciclohexano D. 1,4-dimetilciclohexano
En el caso A un grupo metilo se encontrará en posición axial y el otro en ecuatorial por lo que las dos conformaciones posibles serán igual de estables.
En cada uno de los casos restantes podemos representar dos estructuras diferentes según si los dos metilos se encuentran en cis (dirigidos hacia el mismo lado del plano) o en trans (dirigidos hacia lados opuestos).
En B el isómero cis debe tener los dos metilos hacia el mismo lado del plano central por lo que un metilo será axial y el otro ecuatorial.
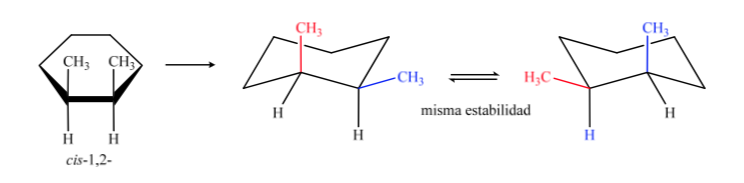
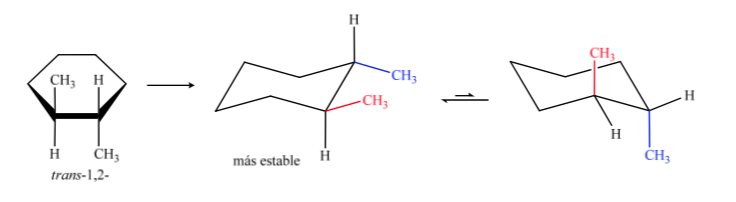
El isómero trans es el que tiene los dos metilos hacia lados opuestos por lo que presentará los dos metilos en posición axial o los dos en ecuatorial. La conformación que presente los dos en ecuatorial es mas estable que en axial por lo tanto podremos decir que el isómero trans-1,2-dimetilciclohexano es más estable que el isómero cis-1,2 –dimetilciclohexano.
En el caso del 1,3-dimetilciclohexano podemos representar:
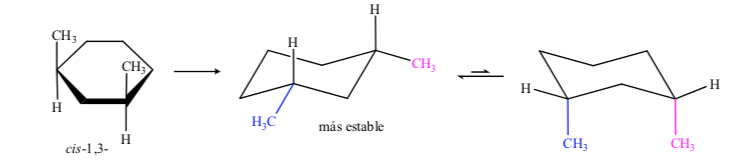
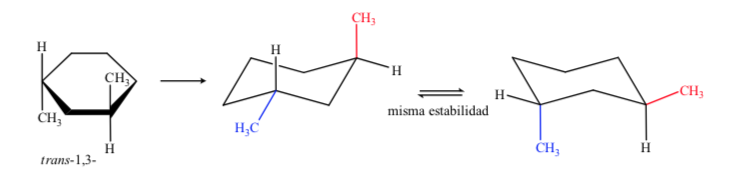
Se concluye que el isómero cis, que presenta los dos sustituyentes en ecuatorial, es más estable que el trans, que siempre tendrá un metilo en axial y otro en ecuatorial.
En el caso D, 1,4-dimetilciclohexano tendremos:
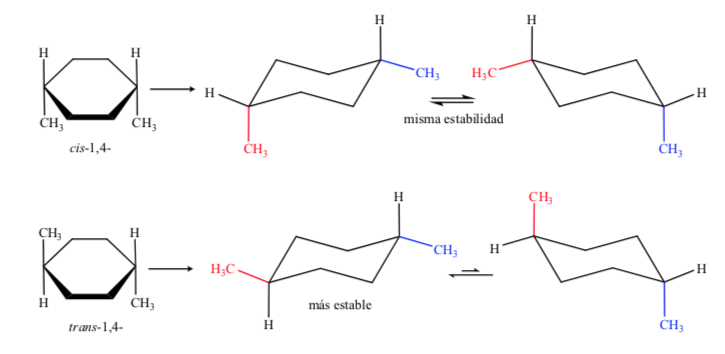
En este caso el isómero trans es más estable por disponer los dos metilos en ecuatorial.
Cuando se trata de ciclohexanos disustituidos con grupos diferentes el isómero más estable será el que tenga el grupo más voluminoso en ecuatorial
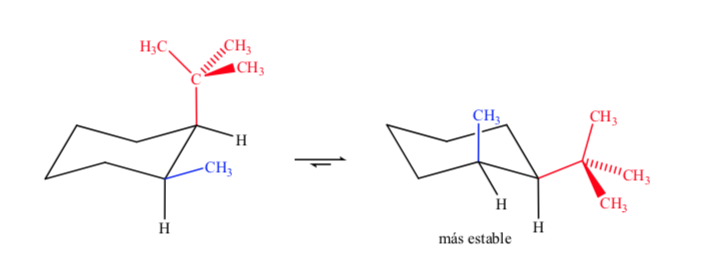
Finalmente, en el caso de ciclohexanos polisustituidos que presenten sustituyentes diferentes la conformación preferente será la que tenga el mayor número de grupos voluminosos en posición ecuatorial.
CONFORMACIÓN EN HETEROCICLOS DE SEIS MIEMBROS:
EFECTO ANOMÉRICO
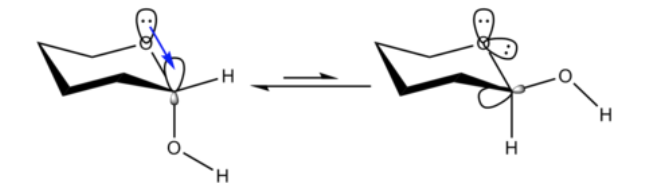
En química orgánica, el efecto anomérico o efecto Edward-Lemieux es un efecto estereoelectrónico que describe la tendencia de los sustituyentes heteroatómicos adyacentes a un heteroátomo en un anillo de ciclohexano a preferir la orientación axial en vez de la orientación ecuatorial menos cubierta, que se esperaría a partir de consideraciones estéricas. Este efecto fue observado originalmente en anillos de piranosa por J. T. Edward en 1955; en aquel tiempo, N.-J. Chii y Raymond U. Lemieuxcomenzaron a estudiar el equilibrio de anomerización de los derivados totalmente acetilados de algunas aldohexopiranosas. El término "efecto anomérico" fue introducido en 1958.
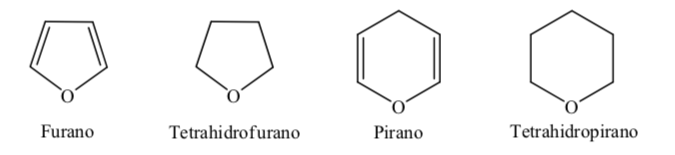
Algunos de los heterociclos de cinco y seis miembros más comunes en los procesos biológicos son:
A. Heterociclos oxigenados:
B. Heterociclos nitrogenados:
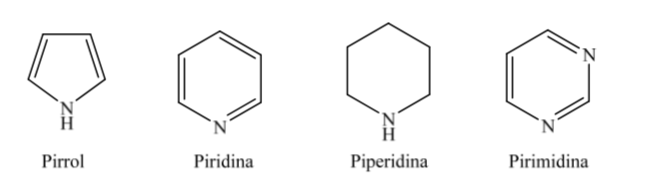
Cuando se trata de heterociclos totalmente hidrogenados de cinco y seis miembros como el tetrahidrofurano y el tetrahidropirano, la conformación más estable que presentan es similar a la del ciclopentano y ciclohexano respectivamente, es decir, conformación sobre o conformaciónsilla.
Los azúcares de 5 y 6 átomos de carbono adquieren una estructura cíclica cuando se forma una unión hemiacetálica por reacción del carbonilo (aldehído o cetona del azúcar) con un grupo hidroxilo.
La reacción de formación del hemiacetal podemos esquematizarla de la forma:
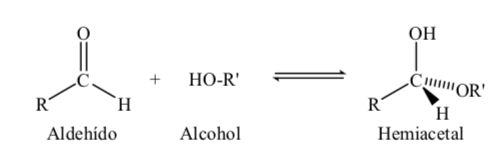
Para su estudio, los azúcares se representan mediante estructuras lineales siguiendo las normas de las proyecciones de Fischer.
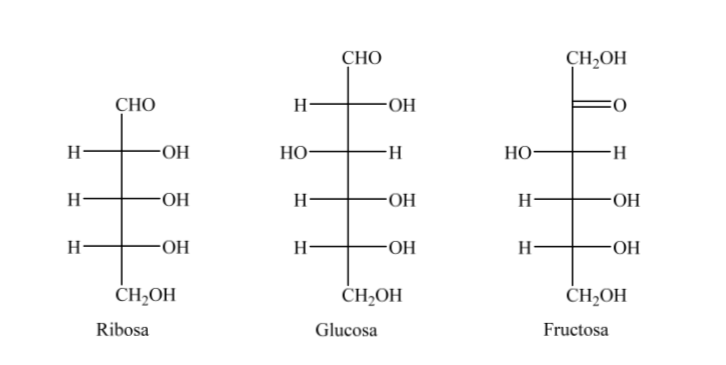
Así, a modo de ejemplo, la ribosa, la glucosa y la fructosa las podemos representar:
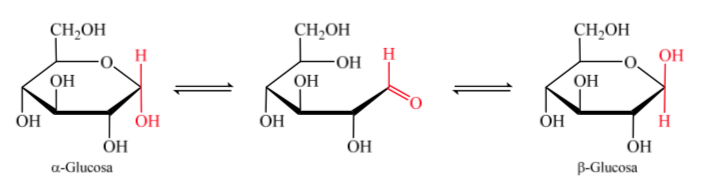
Al formarse el hemiacetal la molécula adquiere una disposición curvada en la que la función aldehído de la aldosa en el carbono 1 se ubica próxima al hidroxilo del carbono 5, produciéndose la adición al doble enlace del carbonilo generando el hemiacetal cíclico de seis miembros (anillo piranósido).
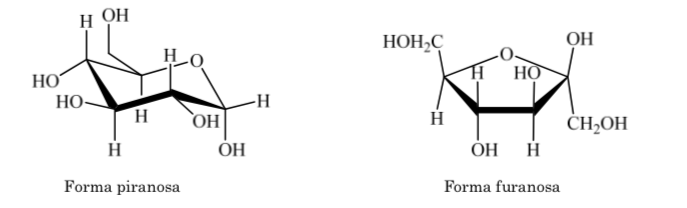
Lo mismo ocurre con las cetosas, pero en este caso la unión hemiacetálica se da entre el carbono 2 y el carbono 5 formándose un anillo de cinco miembros. (anillo furanósido).
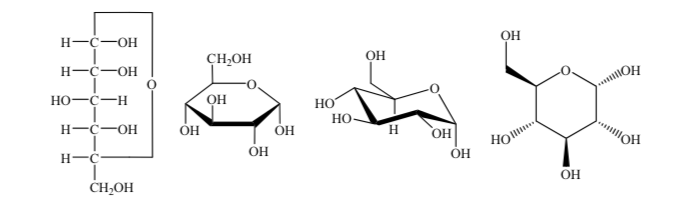
Se utilizan diferentes formas de representar la estructura de la glucosa en forma cíclica:
Anómeros
Se denominan anómeros a los isómeros de los monosacáridos de más de 5 átomos de carbono que han desarrollado una unión hemiacetálica lo que les ha permitido tomar una estructura cíclica y determinar 2 diferentes posiciones para el grupo hidroxilo (α o β) en el nuevo centro creado.
El anillo de piranosa debe ser similar al del ciclohexano y existir en conformación silla en preferencia a la de bote torcido para reducir al mínimo las tensiones torsionales. El análisis de rayos X demuestra que estas suposiciones son correctas.
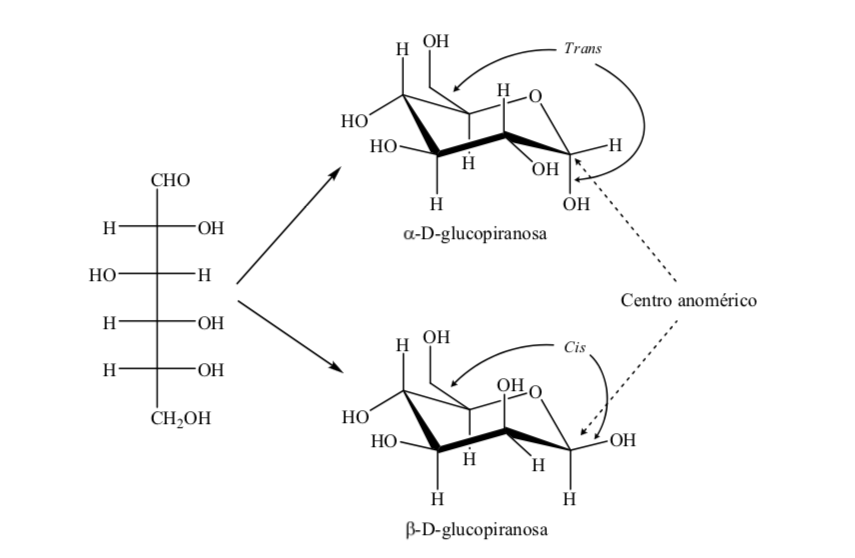
Los dos anómeros son designados anómeros alfa (α) o beta (β), de acuerdo con la relación configuracional entre el centro anomérico y el átomo de referencia anomérico. El centro anomérico está en el carbono hemiacetálico y es el carbono anomérico C-1, que se une a través del oxigeno al C-5, que se une al oxígeno hemicetálico.
Hay sin embargo dos posibles conformaciones silla para un mismo anómero de la D-(+)-glucopiranosa.
Así, Para la β-D-(+)-glucopiranosa hay dos posibles conformaciones. Será más estable aquella que presenta los grupos más voluminosos en ecuatorial (A).
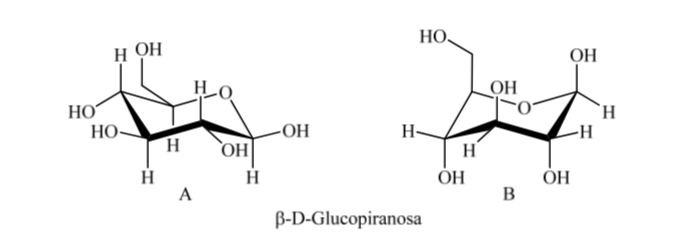
¿Qué sucede para la α-D-(+)-glucosa? En este caso la conformación más estable es aquella en la que el OH en el carbono anomérico está en axial y los grupos voluminosos en ecuatorial (A).
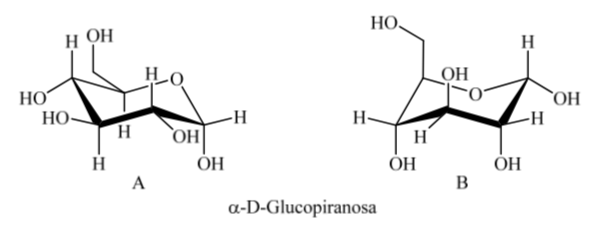
Es interesante observar que de todas las D-aldohexosas, solo la β-D- (+)-glucopiranosa puede asumir una conformación en la que cada uno de sus grupos grandes puede ocupar una posición ecuatorial. Esto concuerda con el hecho de que la β -D-(+)-glucopiranosa sea el azúcar de mayor presencia en la naturaleza.
Efectos electronicos
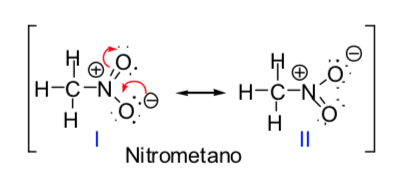
Algunas moléculas orgánicas se pueden representar mediante dos o más estructuras de Lewis, que difieren entre sí únicamente en la colocación de los electrones y que se denominan estructuras resonante s. En estos casos, la molécula tendrá características de ambas estructuras y se dice que en realidad la molécula es un híbrido de resonancia de las estructuras resonantes. El método de la resonancia permite saber, de forma cualitativa, la estabilización que puede conseguir una molécula por deslocalización electrónica. Cuanto mayor sea el número de estructuras resonantes mediante las que se puede describir una especie química mayor será su estabilidad.
El concepto de estructuras resonantes se puede aplicar en la descripción del nitrometano, que se puede representar mediante las dos estructuras de Lewis que se indican a continuación:
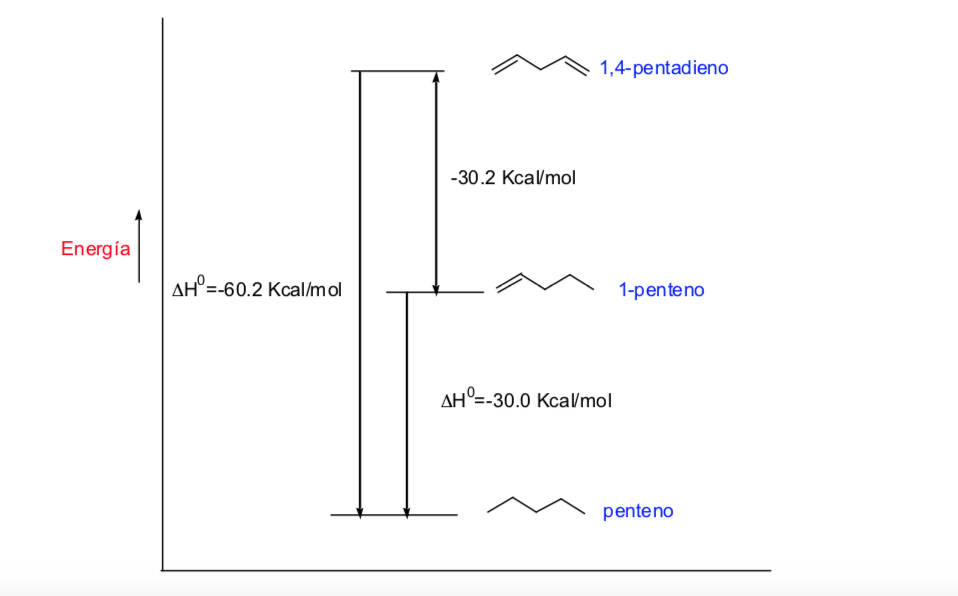
Enlaces conjugados y su energia
Analisis conformacional de la aromaticidad
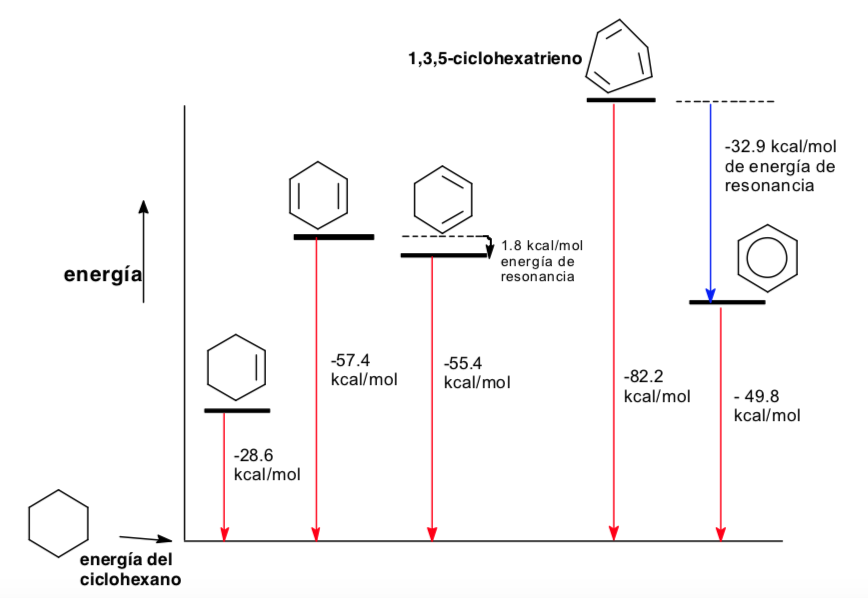 Termodinamica y el analisis conformacional (fectos estereoelectronicos)
Termodinamica y el analisis conformacional (fectos estereoelectronicos)
No es inesperado que el sustituyente metoxilo en un anillo de ciclohexano prefiera adoptar la conformación ecuatorial.
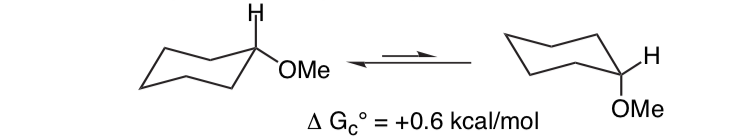
Lo que es inesperado es que el 2-metoxitetrahidropirano estrechamente relacionado Cl H O Prefiere la conformación axial:
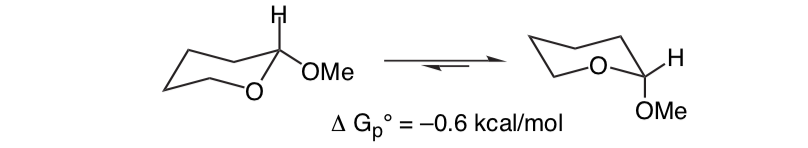
Este efecto que proporciona la estabilización del conformador axial O que anula el sesgo estérico inherente del sustituyente se denomina efecto anomérico.
De la siguiente manera quedaria la relacion de la energia libre respecto al efecto anomerico:
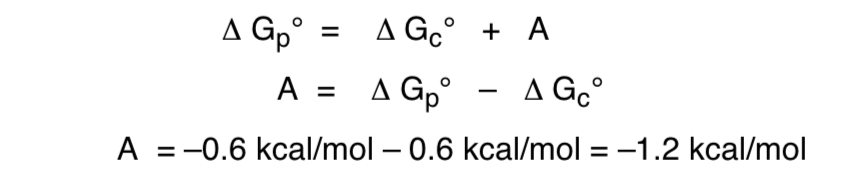
Fuentes recomendadas para expandir la busqueda :
1) Juaristi E. “Conceptos básicos de la teoría orbital”. CINVESTAV, México, 1988 Juaristi E. “Fisicoquímica Orgánica”. CINVESTAV, México, 1994.
2) Neil S. I. “Physical Organic Chemistry” Longman, Milan, 1995.
3) March J., “Advanced Organic Chemistry” John Wiley & Sons, New York, 1992 4) Jones R. A. Y. “Physical and Mechanistic Organic Chemistry”, 2nd. Ed Cambrige University Press, Cambrige, 1984 .
5) Woodward R. B. y Hoffmann R. “The conservation of orbital symmetry”, Academic Press, New York, 1979.
6) Carpenter B. K. “Determination of Organic Reaction Mechanisms”, John Wiley & Sons, New York, 1984 .