I nucleofili sono basi di Lewis che attaccano un carbonio, spostando il gruppo uscente. I nucleofili ionici sono comuni, ma ci sono anche numerosi esempi di nucleofili neutri. La caratteristica generale di tutti i nucleofili è la presenza di coppie solitarie sull'atomo attaccante.
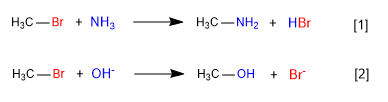
Lento
veloce
Nella prima reazione, l'ammoniaca agisce come un nucleofilo - specie neutra, ma con coppie solitarie sull'azoto - spostando il bromo dal carbonio e formando un'ammina.
Nella seconda reazione, lo ione idrossido agisce come un nucleofilo, spostando il bromo e formando un alcol. Si osserva che la prima reazione è più lenta della seconda, in conclusione l'ammoniaca è un nucleofilo peggiore dello ione idrossido.
La capacità di un nucleofilo di attaccare un substrato è nota come nucleofilia, che dipende da diversi fattori: posizione dell'atomo attaccante nella tavola periodica, carica e risonanza.
Carica - Le specie cariche sono nucleofili migliori di quelle neutre
OH ->> H 2 O ione idrossido (specie carica) migliore nucleofilo dell'acqua (specie neutra)
NH 2 ->> NH 3 Ione ammide (specie carica) nucleofilo migliore dell'ammoniaca (specie neutra)
PH 2 ->> PH 3 Ione fosfuro (specie carica) nucleofilo migliore della fosfina (specie neutra)
Posizione sulla tavola periodica - La nucleofilia aumenta scendendo lungo la tavola periodica e spostandosi verso sinistra.
NH 3> H 2 O l'ammoniaca è un nucleofilo migliore dell'acqua perché l'azoto è più a sinistra dell'ossigeno
I -> Cl - lo ioduro è un nucleofilo migliore del cloruro perché è più in basso.
PH 3> NH 3 fosfina è un nucleofilo migliore dell'ammoniaca perché il fosforo è inferiore all'azoto.
Risonanza - La risonanza diminuisce la nucleofilia. La delocalizzazione delle coppie solitarie diminuisce la capacità di attacco del nucleofilo.
OH -> CH 3 COO - Lo ione acetato è peggio nucleofilo dello ione idrossido a causa della delocalizzazione della carica su entrambi gli ossigeni.









