Nukleofil adalah basa Lewis yang menyerang karbon, menggantikan gugus pergi. Nukleofil ionik adalah umum, tetapi ada juga banyak contoh nukleofil netral. Karakteristik umum dari semua nukleofil adalah adanya pasangan mandiri pada atom penyerang.
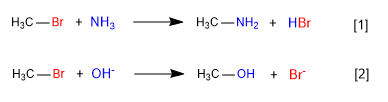
[1 ] Lambat
[2 ] Cepat
Pada reaksi pertama, amonia bertindak sebagai spesies netral nukleofil, tetapi dengan pasangan elektron bebas pada nitrogen menggantikan bromin dari karbon dan membentuk amina.
Pada reaksi kedua, ion hidroksida bertindak sebagai nukleofil, menggantikan bromin dan membentuk alkohol. Diamati bahwa reaksi pertama lebih lambat dari yang kedua, kesimpulannya amonia adalah nukleofil yang lebih buruk daripada ion hidroksida.
Kemampuan nukleofil untuk menyerang substrat disebut nukleofilisitas Nukleofilisitas bergantung pada beberapa faktor: posisi atom penyerang dalam tabel periodik, muatan, dan resonansi.
Mengisi - Spesies bermuatan adalah nukleofil yang lebih baik daripada yang netral
OH ->> H 2 O ion hidroksida (spesies bermuatan) nukleofil lebih baik daripada air (spesies netral)
NH 2 ->>> Ion NH 3 amida (spesies bermuatan) nukleofil lebih baik daripada amonia (spesies netral)
PH 2 ->>> PH 3 ion fosfida (spesies bermuatan) nukleofil lebih baik daripada fosfin (spesies netral)
Posisi pada tabel periodik - Peningkatan nukleofilisitas menuruni tabel periodik dan bergerak ke kiri.
NH 3> H 2 O amonia adalah nukleofil yang lebih baik daripada air karena nitrogen lebih ke kiri daripada oksigen
I -> Cl - iodida adalah nukleofil yang lebih baik daripada klorida karena lebih rendah.
PH 3> NH 3 fosfin merupakan nukleofil yang lebih baik daripada amonia karena fosfor lebih rendah daripada nitrogen.
Resonansi - Resonansi menurunkan nukleofilisitas. Delokalisasi pasangan mandiri menurunkan kemampuan nukleofil untuk menyerang.
OH -> CH 3 COO - Ion asetat lebih buruk nukleofiliknya daripada ion hidroksida karena delokalisasi muatan pada kedua oksigen.









