Reaktionen in der organischen Chemie
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 11160
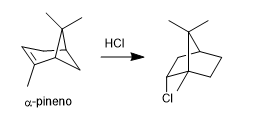
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 12778
Die Wacker-Oxidation ermöglicht die Umwandlung von Alkenen in die entsprechenden Ketone durch Behandlung mit Pd in Gegenwart von Kupfersalzen. Kupfer hat die Fähigkeit, Palladium(0) zu Palladium(II) zu oxidieren, wobei letzteres das katalytische Mittel in der Reaktion ist.
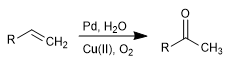
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 13490
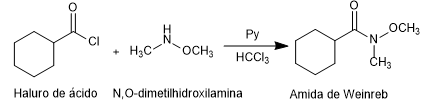
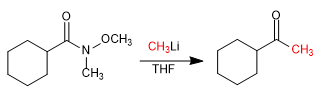
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 7393
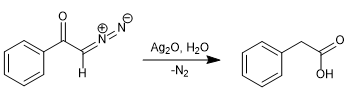
1902 beobachtete Wolff, dass die Behandlung von Diazoacetophenon (α-Diazoketon) mit Ag 2 O/H 2 O zu einer Umlagerung führte, die Phenylessigsäure erzeugte.
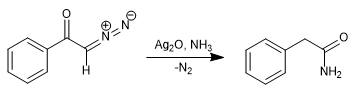
Durch Ersetzen von Wasser durch Ammoniak wird Phenylacetamid erhalten.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 14476
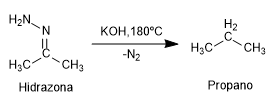
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 22838
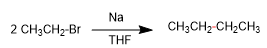
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 10649
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 7890
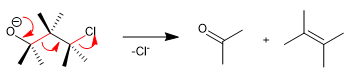
Die Wharton-Fragmentierung ist eine konzertierte Reaktion, bei der sich eine Abgangsgruppe in Position 4 in Bezug auf eine elektronenspendende Gruppe befindet. Die Übertragung der freien Paare der Donorgruppe bewirkt die Fragmentierung der Nachbarbindung und den Verlust der Abgangsgruppe unter Bildung von Doppelbindungen. Sehen wir uns ein Beispiel an:
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 6797
Die Wharton-Synthese ermöglicht die Umwandlung von α,β-Epoxyketonen in Allylalkohole durch Behandlung mit Hydrazin in Essigsäuremedium oder Hydrazinhydrat, gefolgt von einer starken Base. Das α,β-Epoxyketon wird aus dem α,β-ungesättigten Keton durch Oxidation mit Wasserstoffperoxid in basischem Medium gewonnen.
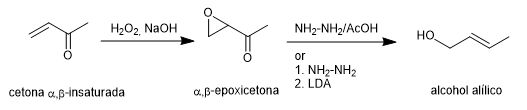
Weiterlesen: Wharton-Synthese von Olefinen (Wharton-Umlagerung)
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 11064
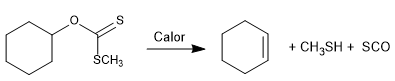
Die Chugaev-Reaktion ermöglicht die Bildung von Olefinen aus Xanthanen.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 20707
Aldehyde, ohne Alpha-Wasserstoffe, ergeben die Cannizzaro-Reaktion bei Behandlung mit einer starken Base (NaOH)
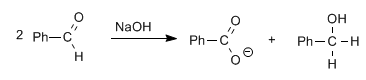
Bei dieser Reaktion wird ein Molekül zu Alkohol reduziert, während das andere zu Carbonsäure oxidiert wird.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 9413
Die Blanc-Reaktion ermöglicht die Chlormethylierung von Aromaten.
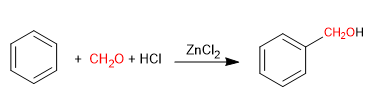
Es verwendet als Reagenzien Methan mit gasförmigem Chlorwasserstoff in Gegenwart einer Lewis-Säure. Das Ergebnis ist die Einführung einer Hydroxymethylgruppe am aromatischen Ring (Benzol), deren Hydroxyl in Gegenwart von Chlorwasserstoff durch Chlor ersetzt wird.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 12464
Die Beckmann-Reaktion erzeugt die Umlagerung eines Oxims in ein Amid. Diese Reaktion wird in einem sauren Medium durchgeführt.
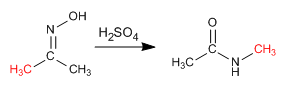
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 13980
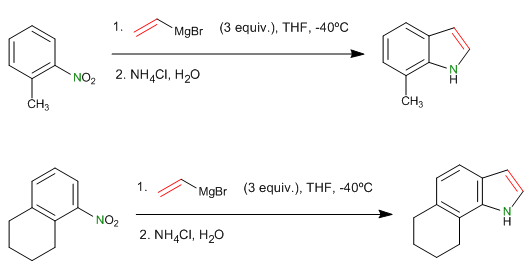
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 8984
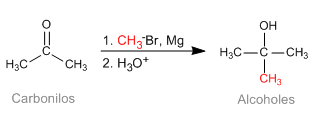
Die Barbier-Reaktion ermöglicht es, im Reaktionsmedium instabile metallorganische Reagenzien zu erhalten. Anfänglich wurde es mit Magnesiummetall durchgeführt, wobei Magnesium in situ erzeugt wurde. Später wurde es auf andere Metalle ausgedehnt: Sn, Zn..., die in wässrigen Medien arbeiten können, ohne dass Säuregruppen (Hydroxyle) geschützt werden müssen.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 10291
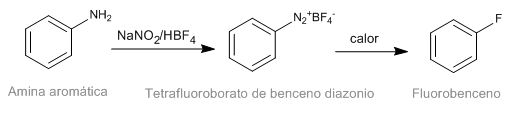
Die Schiemann-Reaktion besteht aus der thermischen Zersetzung von aromatischen Diazoniumtetrafluorboraten, um das entsprechende fluorierte Derivat zu ergeben. Obwohl Diazoniumsalze nicht testbar sind, haben Diazoniumtetrafluorborate eine beträchtliche Stabilität und können in guter Ausbeute hergestellt werden. Diazoniumtetrafluorborat wird aus aromatischen Aminen durch die Diazotierungsreaktion hergestellt.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 8476
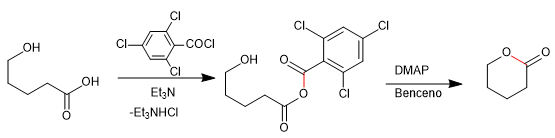
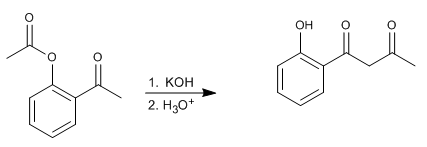
Die Baker-Venkataraman-Umlagerung wandelt aromatische ortho-Acyloxyketone durch basische Behandlung (Katalyse) in beta-Diketone um. Beta-Diketone sind von großem Interesse bei der Synthese von Chromonen, Flavonen und Cumarinen. Die am häufigsten verwendeten Basen in der Reaktion sind: KOH, Kalium-tert-butoxid, Natrium in Toluol, Kaliumhydrid.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 9965
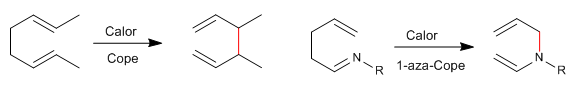
1,5-Diene isomerisieren beim Erhitzen durch sigmatrope-[3,3]-Umlagerungen. Als Cope-Umlagerung bekannte Reaktion. Die Umlagerung von N-substituierten 1,5-Dienen wird als Aza-Cope-Umlagerung bezeichnet. Je nach Position des Stickstoffs haben wir: 1-Aza-, 2-Aza-, 3-Aza-Cope. Die 3-Aza-Cope-Umgruppierung fällt mit der Aza-Claisen zusammen.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 9576
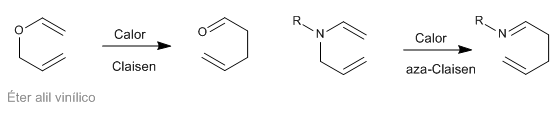
Sigmatrope [3,3]-Umlagerungen von N-Allylenaminen sind als Aza-Claisen-Umlagerungen bekannt. Diese Reaktion ist analog zur Claisen-Umlagerung von Allylvinylethern.
- Details
- Germán Fernández
- Reaktionen in der organischen Chemie
- Zugriffe: 8181
Reaktion analog zur Wittig-Umlagerung, bei der Alpha-Metallether Alkoholate umlagern und nach Hydrolyse sekundäre oder tertiäre Alkohole erzeugen. Im Fall von Aza-[2,3]-Wittig sind dies alpha-metallierte allylische tertiäre Amine, die nach Hydrolyse sekundäre Amine erzeugen.










