¿QUÉ ES LA SÍNTESIS ASIMÉTRICA?
La síntesis asimétrica o también llamada síntesis quiral o enantioselectiva , es aquella que introduce o favorece una quiralidad deseada . Esta rama de la síntesis orgánica es de vital importancia para la fabricación de medicamentos ya que estos en el organismo mediante diversos mecanismos metabólicos solo funcionan a una quiralidad especifica de las enzimas presentes en el proceso.
CONCEPTOS BÁSICOS EN SÍNTESIS ASIMÉTRICA:
PROCESO REGIOSELECTIVO:
Una reacción se denomina regioselectiva cuando se produce mayoritariamente uno de los posibles isómeros estructurales:
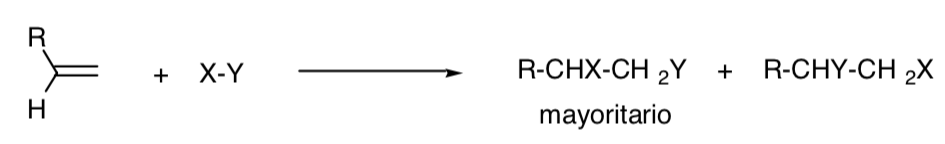
PROCESO REGIOESPECÍFICO:
Una reacción se denomina regioespecífica cuando se forma exclusivamente uno de los posibles isómeros estructurales:
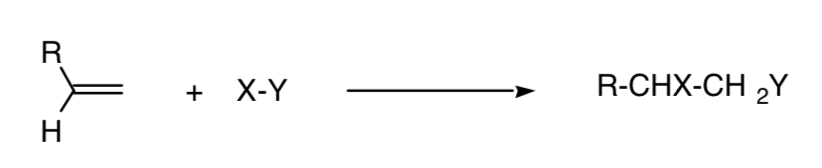
Este concepto se puede extender a otros procesos, como es el caso de los procesos de cicloadición 4+2:
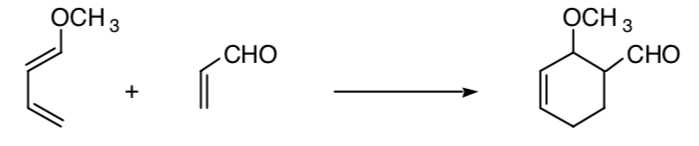
SÍNTESIS ESTEREOSELECTIVA:
Una síntesis se denomina estereoselectiva cuando se origina un estereoisómero de una determinada estructura en una proporción considerablemente superior al resto de los restantes estereoisómeros de la misma estructura.
Se habla de proceso enantioselectivo cuando uno de los enantiómeros es mayoritario y de proceso diastereoselectivo cuando se forma mayoritariamente un diastereómero, o racemato diastereomérico.
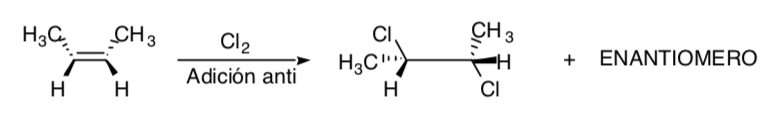
SÍNTESIS ESTEREOESPECÍFICA:
Es aquella en la que diferentes estereoisómeros del substrato de partida originan productos estereoisoméricamente diferentes:
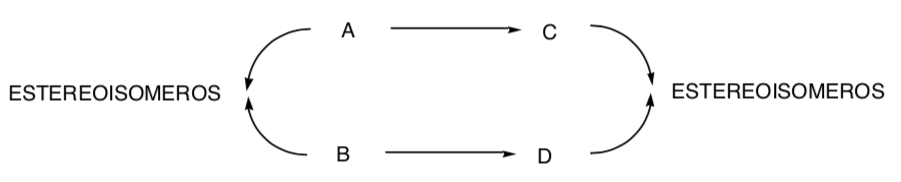
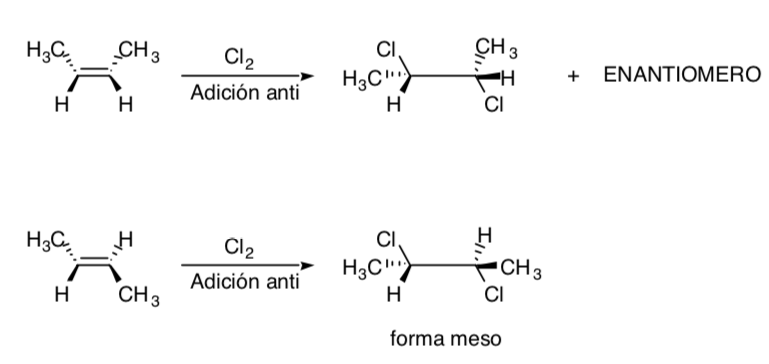
La cloración de alquenos es un ejemplo de proceso estereoespecífico:
CONTROL ESTEREOSELECTIVO DE UNA SÍNTESIS :
La necesidad de un control estereoselectivo en la creación de nuevos centros de quiralidad queda de manifiesto en la reducción sucesiva de uno de los grupos carbonilo y del doble enlace presentes en la cetona de Wieland-Miescher. Si el proceso no es estereoselectivo se obtendran cuatro estereoisómeros del producto final:
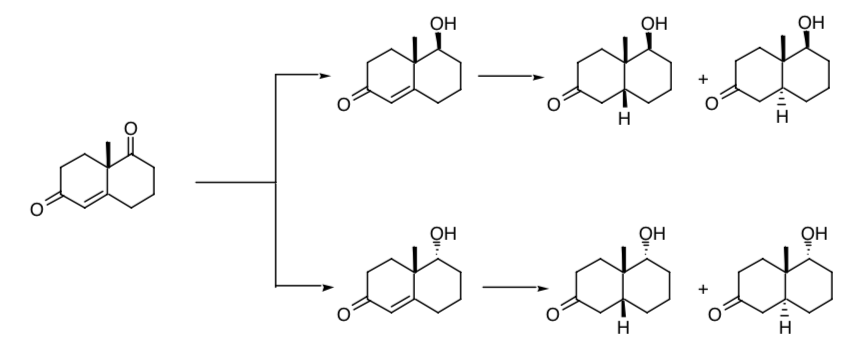
Si partimos del racemato de dicha cetona obtendremos, del proceso de reducción, ocho posibles estereoisómeros.
CONSIDERACIONES ESTEREOQUÍMICAS:
Una simplificación del problema estereoquímico puede consistir en eliminar todos los centros de quiralidad y planear una síntesis del modo más estereoselectivo posible, para lo cual ha de tenerse en cuenta no sólo la configuración de cada centro quiral sino la influencia de unos centros quirales sobre otros. Si esta influencia no existe (porque están distantes) se puede simplificar el problema partiendo de unidades estructurales que incluyan los centros quirales con la configuración adecuada.
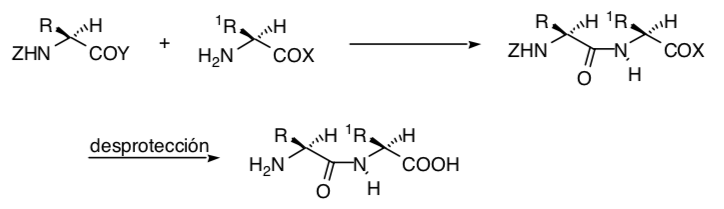
A veces es posible emplear grupos funcionales remotos como sintones control, como es el caso de la ciclopropanación de Simmons-Smith en la que un grupo hidroxilo permite efectuar la ciclopropanación de modo estereoselectivo por coordinación del grupo hidroxi con la especie carbenoide:
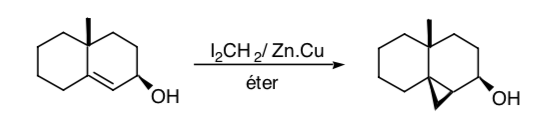
CONSIDERACIONES DE SIMETRIA:
El reconocimiento de una simetría en la molécula puede ser de gran utilidad como es el caso del escualeno:
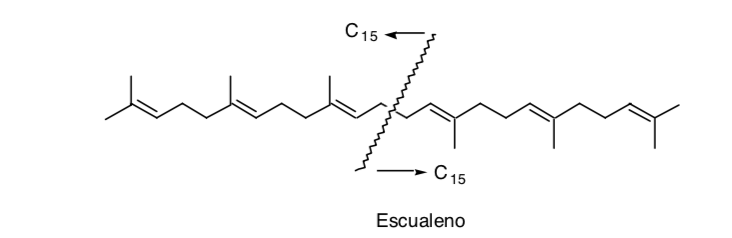
Aunque en realidad su síntesis no se efectuó por dimerización (C15 + C15) sino por adición de dos unidades C11 a una unidad central C8 (C11 + C8 + C11).
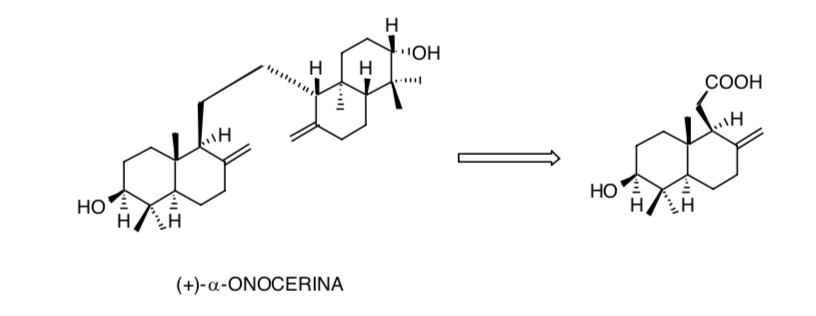
La consideración de la simetría en la molécula de (+)-α-onocerina reduce el problema de crear ocho centros quirales a solamentecuatro:
Fuentes recomendadas para expandir la información:
1) Guo-Qiang Lin, Yue-Ming Li, Albert S. C. Chan. Principles and Applications of Asymmetric Synthesis. Ed. Wiley-Interscience. Great Britain, 2001.
2) Mark Rizzacasa and Michael Perkins. Stoichiometric Asymmetric Synthesis. Ed. Sheffield Academic Press. U.S.A and Canada. 2000.
3) Jonathan M. J. Williams. Catalysis in Asymmetric Synthesis. Ed. Sheffield Academic Press. U.S.A and Canada. 1999.
4) R. A. Aitken and S.N. Kulényi. Asymmetric Synthesis. Ed. Blackie Academic and Professional. Great Britain, 1992.
5) Grossman R.B. The Art of Writing Reasonable Organic Reaction Mechanisms. Springer, New York. 2003
6) Norman R.O.C.; Coxon J. M. Principles of Organic Synthesis. CRC Press, Boca Ratón. 1993









