Una molécula quiral es aquella que no es superponible con su imagen especular. La simetría provoca que las moléculas pierdan su quiralidad. Así, la presencia de planos de simetría, centros de inversión o ejes alternantes dan lugar a moléculas aquirales.
a) Eje de simetría (Cn)
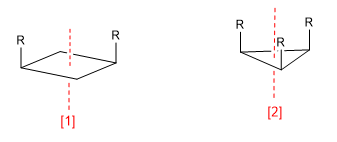
[1 ] Eje de simetría (C2)
[2 ] Eje de simetría (C3)
Un eje de simetría de orden m deja a la molécula en una configuración indistinguible de la inicial al girar 360/m grados.
b) Plano de reflexión (s): Divide a la molécula en dos partes iguales. Todo átomo de la molécula que se encuentre a un lado del plano debe tener su simétrico al otro lado.
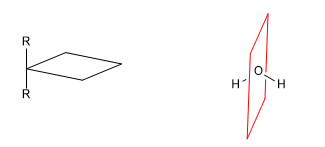
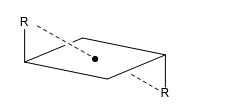
c) Centro de simetría (i): Todo átomo de la molécula tiene su simétrico respecto de un punto situado en el centro de la molécula.
d) Eje alternante o impropio (Sn): El eje alternante consta de dos operaciones de simetría, un giro Cm y una reflexión en un plano perpendicular al eje.
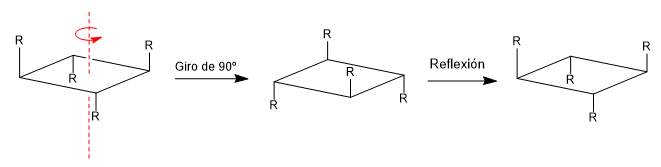
Una molécula es aquiral si contiene un plano, centro o eje alternante de simetría. La presencia de ejes Cn no convierte a una molécula en aquiral como puede observarse en el siguiente ejemplo.
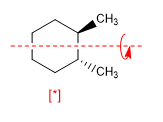
[*] Molécula quiral con eje C2
 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?