Die Kontrolle in der organischen Synthese ist eine der wichtigsten Aufgaben, um die gewünschte oder geplante Umwandlung zu erreichen. und/oder zu vermeiden die Bildung solcher Nebenprodukte, die den optimalen Ablauf der betreffenden organischen Synthese wesentlich beeinträchtigen. Ebenso kann die Kontrolle allgemeiner betrachtet auch die Aspekte Symmetrie und Selektivität umfassen bzw. abdecken.
Dann sollte Kontrolle als eine Reihe von Syntheseoperationen verstanden werden, die es dem Chemiker ermöglichen, das Kohlenstoffgerüst mit der beabsichtigten Funktionalität zu bilden oder eine Gruppe oder ein Atom an der erforderlichen Stelle oder Position zu "platzieren".
Folglich können diese Operationen zu einer Vielzahl von Routinen gehören, die eine vom Chemiker widergespiegelte Absicht haben und die bestimmte kognitive Fähigkeiten und Fertigkeiten erfordern, die künstlerischen ähnlich sind, für die Konstruktion (Synthese) organischer Moleküle.
Daher können bei Kondensationsreaktionen wie bei anderen Steueroperationen in eine der folgenden Kategorien eingeschlossen werden.
![]() Konkurrenzreaktionen (Selbstkondensation und/oder Kreuzkondensation)
Konkurrenzreaktionen (Selbstkondensation und/oder Kreuzkondensation)
![]() Aktivierung – Deaktivierung
Aktivierung – Deaktivierung
![]() Selektivität und Spezifität
Selektivität und Spezifität
![]() Schutz-Entschützung
Schutz-Entschützung
Bei den Kondensationsreaktionen von Carbonylverbindungen ist es wichtig, die Reihenfolge der Ereignisse im Voraus festzulegen, um die Möglichkeiten der Selbstkondensation und das Auftreten von Kreuzkondensation, die leider eine offensichtliche Bedrohung bei diesen Reaktionen darstellen, zu minimieren oder gegebenenfalls zu unterdrücken .
Selbstkondensation
Alle Carbonylverbindungen mit einem oder mehreren alpha-Wasserstoffen an den Kohlenstoffen neben der Carbonylgruppe laufen Gefahr, eine Selbstkondensationsreaktion zu erleiden, wenn die entsprechende Strenge nicht befolgt wird.
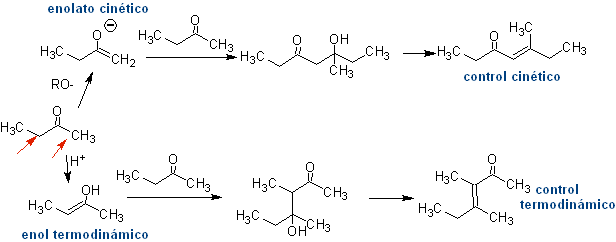
Wenn also beispielsweise eine nicht-hydroxylierte Base wie EtONa zu einem 2-Butanon hinzugefügt wird, wird ein Enolat gebildet, das sich schließlich mit einem anderen Molekül desselben Ketons verbinden könnte. Ebenso kann es bei Zugabe von H+ auch zur Selbstkondensation kommen, wie aus dem folgenden Schema ersichtlich: Dies kann minimiert werden, indem die Base oder Säure zu der Verbindung, die das Enol oder Enolat liefert, und der Carbonylverbindung, die am Carbonylkohlenstoff angegriffen wird, mit der gleichen Geschwindigkeit aus getrennten Zuführungen zugegeben wird . Ein Dreihalskolben und Magnetrührer können verwendet werden.
Kreuzkondensation
Idealerweise sollte bei Kondensationsreaktionen von Carbonylverbindungen eines der reagierenden Moleküle schnell enolisieren, während das andere vorzugsweise kein Hα aufweisen sollte. , um sicherzustellen, dass keine anderen Nebenprodukte gebildet werden
Die nachstehend analysierte Retrosynthese ist ein gutes Beispiel für das, was zuvor angedeutet wurde.
Intramolekulare Kondensation .
Wenn in einem Molekül zwei funktionelle Gruppen vorhanden sind, die die Alpha-Kohlenstoffe in Bezug auf das Carbonyl direkt beeinflussen, ist es höchstwahrscheinlich, dass es zu einer intramolekularen Selbstkondensation kommt und die gebildeten Zyklen eine hohe Stabilität aufweisen müssen, wie im Fall von Ringen von fünf und sechs Gliedern. Ringe mit einer größeren Anzahl von difunktionalisierten Verknüpfungen (7, 8 usw.) sind aufgrund der Labilität dieser Zyklen keine wahrscheinlichen Produkte.
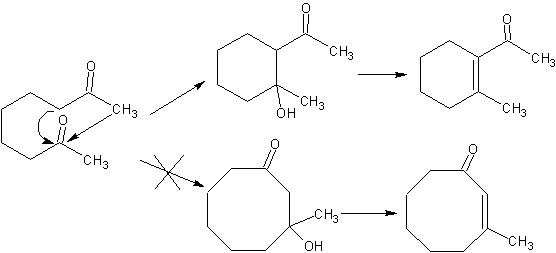
Verwendung der Mannich-Reaktion.
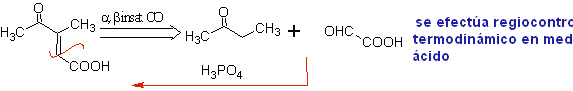
Bei konjugierten Additionsreaktionen an alpha, beta-ungesättigten Carbonyl ( α, β-InssatCO)-Substraten, die für die Michael-Reaktion charakteristisch sind, erscheint die Notwendigkeit, Vinylketone zu verwenden. Aber wenn versucht wird, es aus der Kondensation des Ketons und des Formaldehyds herzustellen, werden andere Polymerisationsprodukte des Aldehyds gebildet, die seine Herstellung erschweren.
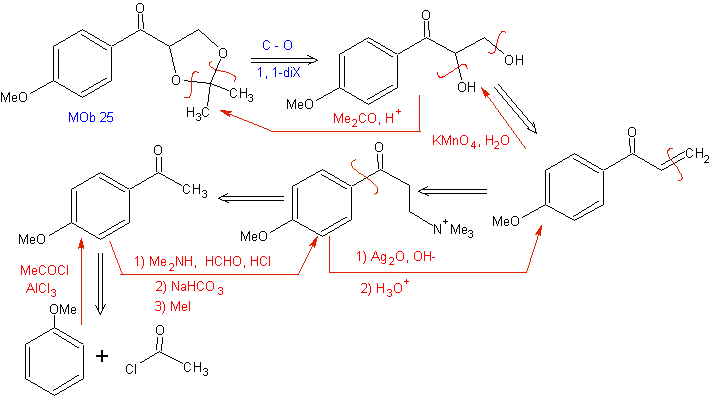
Die Mannich-Reaktion ermöglicht den Erhalt von Vinylketonen während der Synthese und zum erforderlichen Zeitpunkt, was auf andere Weise ernsthafte Schwierigkeiten bei seiner Herstellung mit sich bringt. Dieser Aspekt wird in der Synthese von MOb 25 veranschaulicht
Aktivierung der Gruppen
System nicht aktiviert:
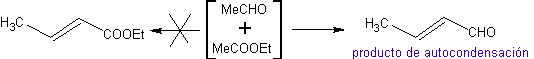
System aktiviert
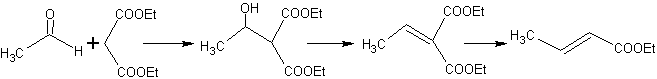
¨ Enamine
Es wurde bereits gesagt, dass ein Weg, ein aktiviertes Enolat zu erhalten, die Bildung eines Enamins zwischen der Carbonylverbindung und einem sekundären Amin ist. Dieser Aspekt wird im folgenden Synthesebeispiel gezeigt.
Retrosynthetische Analyse: Bei der Synthese von MOb 26 wird die richtige Verwendung von Enaminen beobachtet, um die Bildung der Verbindung 1,3 diCO zu gewährleisten.
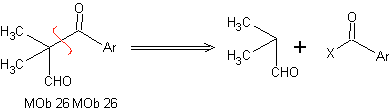
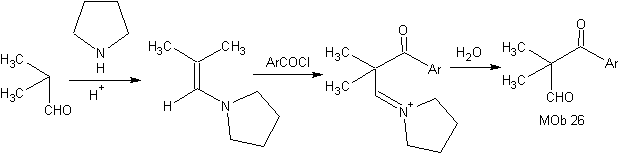
Synthese: Das gebildete Enamin ermöglicht seine entsprechende Acylierung, um das Mob26 zu erreichen
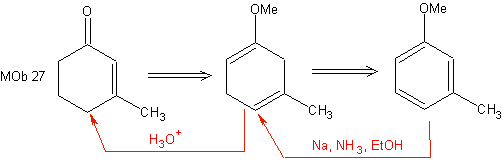
¨ Birke Reduktion
Diese Reduktion stellt eine gute Alternative zur Herstellung von Cyclohexenonen dar, wie die Synthese von MOb 27 zeigt:
Es sollte jedoch daran erinnert werden, dass bestimmte α, β-Verbindungen -Carbonyl ungesättigt, kann auch durch die Wittig-Reaktion und durch die Reformatsky-Reaktion hergestellt werden.
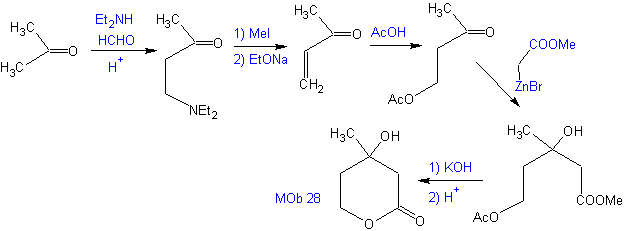
Schlagen Sie einen Syntheseplan aus einfachen Materialien für MOb 28 vor.
Retrosynthetische Analyse: Zunächst wird das Lacton getrennt, gefolgt von einer Trennung als 1,3-diO-Muster. Die gebildete α,β-ungesättigte Carbonylverbindung (α,β- insat. CO) könnte durch die Hoffmann-Eliminierung und das Ketoamin durch die Mannich-Reaktion erhalten worden sein
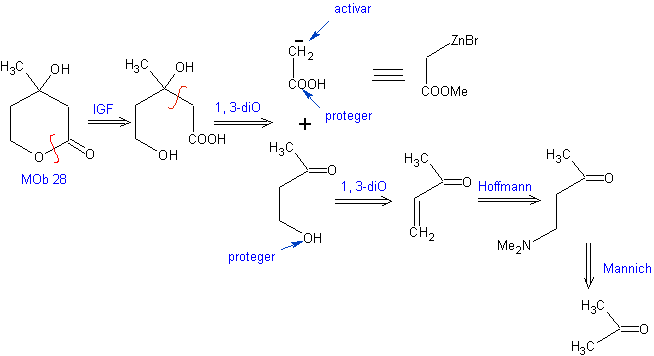
Synthese: Die Synthese von Mob 28, ist sehr geeignet, um die Kontrolle zu zeigen, die über bestimmte Reaktionszentren ausgeübt werden muss, um die gewünschten und notwendigen Transformationen zu erreichen.