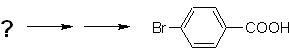SYNTHESE VON AROMATISCHEN VERBINDUNGEN I
(Synthesebaum-Methode)
Schlagen Sie einen Syntheseplan mit Toluol oder Xylol als Ausgangsmaterialien für die folgenden Moleküle vor:
(MOb 12)
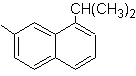
1-Isopropyl-7-methylnaphthalin | (MOb 13)
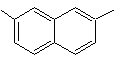
2,7-Dimethylnaphthalin |
(MOb 14)
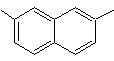
1-Isopropyl-6-methylnaphthalin | (MOb 15)
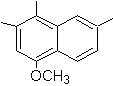
4-Methoxy-1,2,7-trimethylnaphthalin |
Lösung: (MOb 12).
Bei der angenommenen Strategie wird berücksichtigt, dass die letzte Stufe auf einen "Aromatisierungsprozess" reagieren kann, für den vorgeschlagen wird, dass das Vorläufermolekül einen nichtaromatischen Ring mit einer Doppelbindung darstellt.
an dem Kohlenstoff, der die Doppelbindung und die Alkylgruppe enthält.
Diese Struktur kann durch die Einwirkung eines Grignards auf ein Carbonyl und die anschließende Dehydratisierung des gebildeten Alkohols erreicht werden. Das Keton wird durch Acylierung an der entsprechenden Benzolverbindung mit Bernsteinsäureanhydrid und seinen anschließenden intramolekularen Acylierungsabschlüssen nach Friedel-Crafts gebildet.
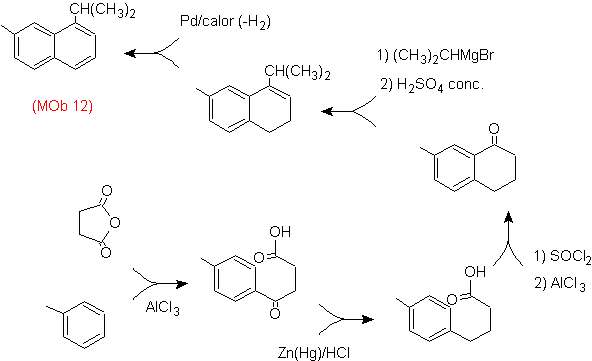
Lösung (MOb 13).
Auch hier muss das Vorläufermolekül "aromatisiert" werden, unter anderem die geeignetste Strategie Es basiert auf der Kombination von Acylierung mit substituiertem Bernsteinsäureanhydrid und der Clemmensen-Reduktion.
Das endgültige Carbonyl wird zu Alkohol reduziert, der dann mit molekularem Wasserstoff und einem Katalysator namens Kupferchromyl dehydriert wird.
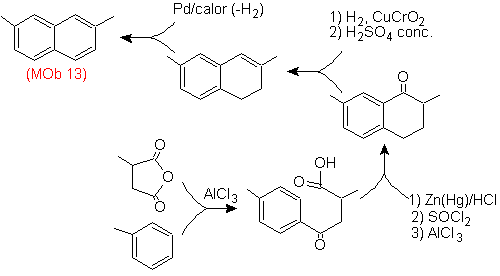
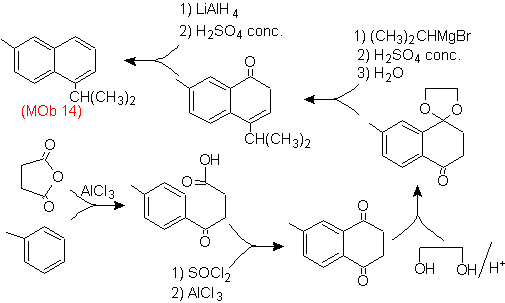
Lösung (MOb 14).
Die endgültige Aromatisierung wird erreicht, nachdem eine Carbonylgruppe zu Alkohol reduziert und anschließend dehydriert wurde. Das Vorläufermolekül wird durch eine Acylierung mit Bernsteinsäureanhydrid erhalten.
Das Carbonyl, das von einem Grignard angegriffen werden muss, um die Alkylgruppe einzuführen und den zu dehydratisierenden Alkohol zu erzeugen, wird vorübergehend als zyklisches Acetal geschützt.
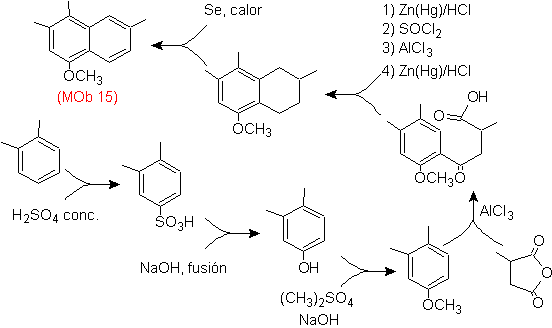
Mob 15- Lösung .
Es wird davon ausgegangen, dass der am stärksten substituierte Ring dem aromatischen Ring entspricht, der durch Acylierung erhalten wurde geeignet mit einem Derivat von Bernsteinsäureanhydrid, ermöglicht es den Ringschluss mit einer intelligenten Kombination aus Acylierung und Reduktion des Carbonyls.
Der Benzolring mit der gewünschten Funktionalität wird aus o-Xylol hergestellt, sulfoniert und die -OH-Gruppe durch Endveretherung geschützt.
Die Acylierung von Naphthalin unterliegt einem interessanten Lösungsmitteleffekt. Die Reaktion in Schwefelkohlenstoff oder halogenierten Lösungsmitteln greift überwiegend in a- Stellung an , in Nitrobenzollösung nimmt jedoch die Größe des elektrophilen Angreifers durch Solvatation mit Nitrobenzol zu und greift die sterisch weniger behinderte b- Stellung an.
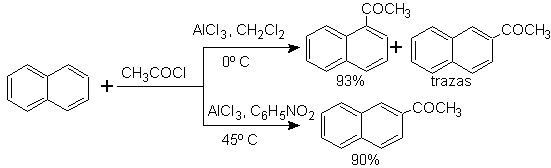
Die Succinoylierung von Naphthalin zu Nitrobenzol erzeugt eine trennbare Mischung von a- und b- Isomeren , die beide bei der Synthese von Phenanthren-Derivaten verwendet werden.
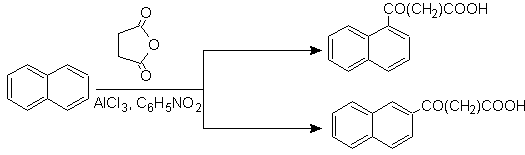
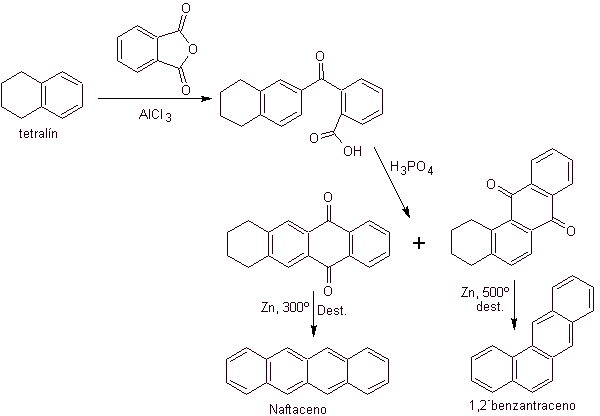
Tetralin wird ausschließlich an der b- Position acyliert , was die Beständigkeit von 2-Phthaloylderivaten gegenüber einer Cyclisierung an der 3-Position unter Bildung linearer Kondensate zeigt.
Beispiel: Synthetisieren Sie p -Brombenzoesäure aus Benzol und den erforderlichen Reagenzien. |
MB 16 |
Lösung (MOb 16).
Es ist notwendig zu fragen: "Was ist ein unmittelbarer Vorläufer von p-Brombenzoesäure?" Die retrosynthetische Analyse von
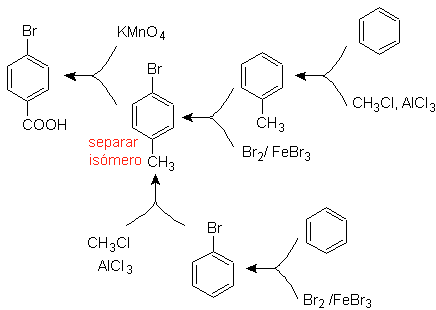
Die beste Option ist diejenige, die Toluol als Zwischenprodukt verwendet, da die Methylgruppe den Benzolring schwach aktiviert und die Ausbeute der Bildung von p-Bromtoluol verbessert.
Beim zweiten Syntheseweg sollte berücksichtigt werden, dass Brom den Ring desaktiviert, und daher wird die Ausbeute der Reaktion offensichtlich viel geringer sein als beim ersten Weg. Es muss jedoch verstanden werden, dass es bei der Synthese kein einziges Produkt gibt, da auch das ortho-substituierte Isomer gebildet wird, das notwendigerweise im Syntheseverfahren abgetrennt werden muss.
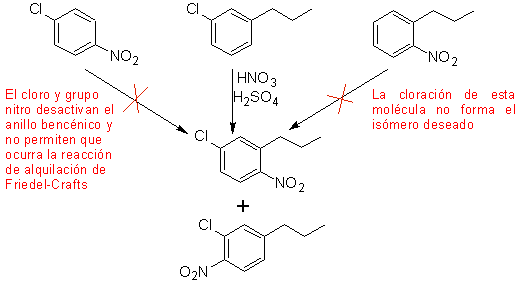
Ein zweiter Fall, der die Charakteristika einer elektrophilen Mehrfachsubstitution des Benzolrings zeigt, ist die Synthese von 4-Chlor-1-nitro-2-propylbenzol (MOb. 17) aus Benzol.
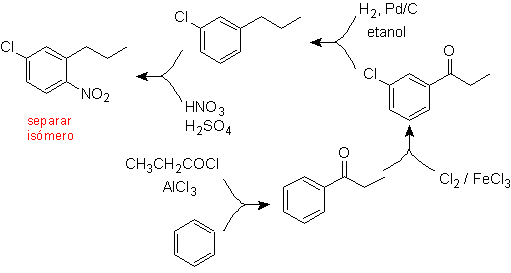
Lösung (MOb 17).
Im Prinzip gibt es drei mögliche disubstituierte Vorstufen, aber nur eine davon ist geeignet. Auch in diesem Fall besteht eine hohe Wahrscheinlichkeit der Bildung des Isomeren 2-Chlor-1-nitro-4-propylbenzol.
die ultimative Synthese von
Heute ist klar, dass eine der Aufgaben des Chemikers das Design ist Synthesewege, die möglichst zu einem einzigen Produkt mit den höchsten Ausbeuten führen, also die Bildung von Isomeren während des gesamten Prozesses vermeiden. Um diesen Aspekt zu veranschaulichen, werden wir die Synthese der folgenden Moleküle untersuchen:
Mob. 18
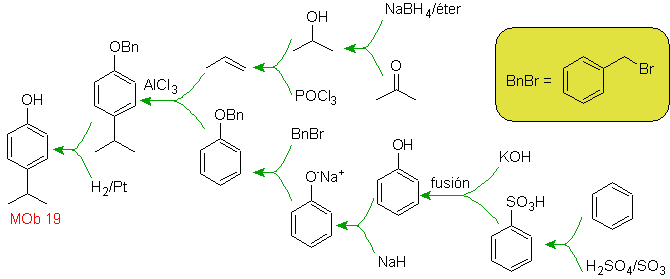
| Mob. 19
|
Lösung MOb 18
Brom ist ortho zum Benzolring orientiert und deaktiviert ihn auch, daher greift die Strategie darauf zurück, eine stark aktivierende Gruppe an den ortho- und para-Positionen eines neuen Elektrophils zu platzieren und nach dem Auslösen der Reaktion die aktivierende Gruppe vom Benzolring zu entfernen.
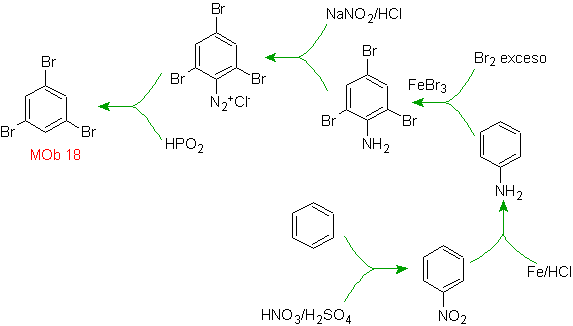
Die -OH-Gruppe ist ein starker Aktivator des Benzolrings und eine ortho-para-Orientierung. Folglich können wir die –OH-Gruppe in eine viel größere, d. h. sperrige Gruppe umwandeln, die für jedes Elektrophil, das sich dem Ring nähert, eine sterische Hinderung ausübt und es nur in die para-Position ausrichtet. Schließlich wird die -OH-Gruppe wiederhergestellt, um das Zielmolekül zu erreichen.