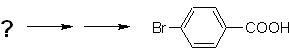СИНТЕЗ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ I
(метод дерева синтеза)
Предложите план синтеза, используя толуол или ксилол в качестве исходных материалов, для следующих молекул:
(Моб 12)
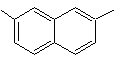
1-изопропил-7-метилнафталин | (Моб 13)
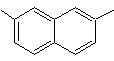
2,7-диметилнафталин |
(Моб 14)
1-изопропил-6-метилнафталин | (Моб 15)
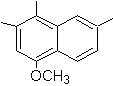
4-метокс-1,2,7-триметилнафталин |
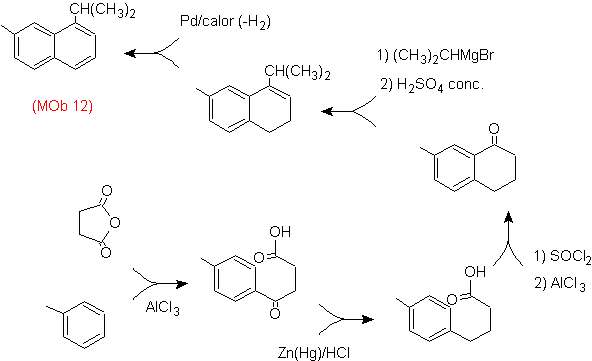
Решение: (MOb 12).
В предполагаемой стратегии учитывается, что последняя стадия может реагировать на процесс «ароматизации», для которого предполагается, что молекула предшественника представляет собой неароматическое кольцо с двойной связью.
на углероде, содержащем двойную связь и алкильную группу.
Эта структура может быть получена действием Гриньяра на карбонил и последующей дегидратацией образовавшегося спирта. Кетон образуется путем ацилирования соответствующего бензольного соединения янтарным ангидридом и его последующего внутримолекулярного ацилирования Фриделя-Крафтса.
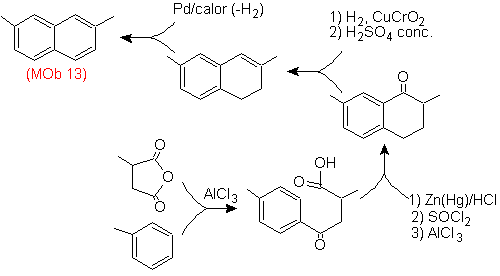
Решение (MOb 13).
Опять же, молекула-предшественник должна быть «ароматизирована», что является наиболее подходящей стратегией среди других. Он основан на сочетании ацилирования замещенным янтарным ангидридом и восстановления Клемменсена.
Конечный карбонил восстанавливается до спирта, который затем дегидратируется молекулярным водородом и катализатором, называемым хромилом меди.
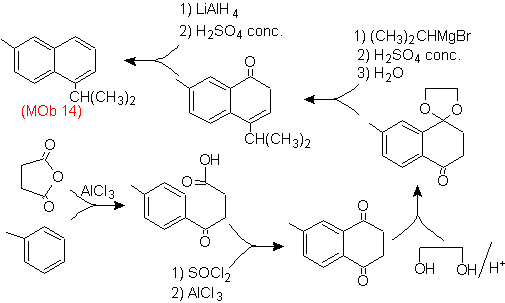
Решение (MOb 14).
Окончательная ароматизация достигается после восстановления карбонильной группы до спирта и последующего его обезвоживания. Молекулу-предшественник получают ацилированием янтарным ангидридом.
Карбонил, который должен быть атакован Гриньяром, чтобы ввести алкильную группу и получить спирт, который будет дегидратирован, временно защищен как циклический ацеталь.
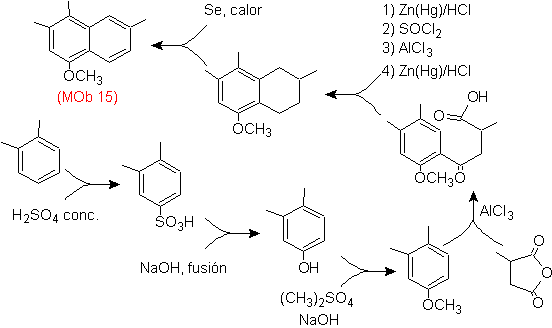
Моб 15 решение .
Считается, что наиболее замещенное кольцо соответствует ароматическому кольцу, которое при ацилировании подходящий с производным янтарного ангидрида, он позволит замкнуть кольцо с разумной комбинацией ацилирования и восстановления карбонила.
Бензольное кольцо с требуемой функциональностью получают из о-ксилола, который сульфируют, а группу –ОН защищают, до конца этерифицируя.
Ацилирование нафталина подвержено интересному эффекту растворителя. Реакция в сероуглероде или галогенированных растворителях вызывает атаку преимущественно в а- положении , однако в растворе нитробензола размер электрофильного атакующего агента увеличивается за счет сольватации нитробензолом, атакуя б- положение , которое менее затруднено стерически.
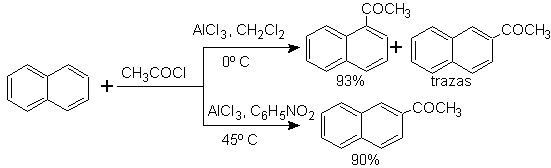
Сукциноилирование нафталина в нитробензол дает разделяемую смесь изомеров a и b , оба из которых используются в синтезе производных фенантрена.
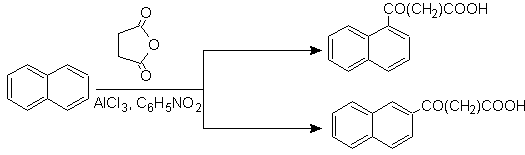
Тетралин ацилируется исключительно в b- положении , демонстрируя устойчивость 2-фталоильных производных к циклизации в 3-положении с образованием линейных конденсатов.
Пример: Синтезировать п -бромбензойную кислоту из бензола и необходимых реагентов. |
Моб 16 |
Решение (MOb 16).
Необходимо спросить: «Что является непосредственным предшественником п-бромбензойной кислоты?» Ретросинтетический анализ
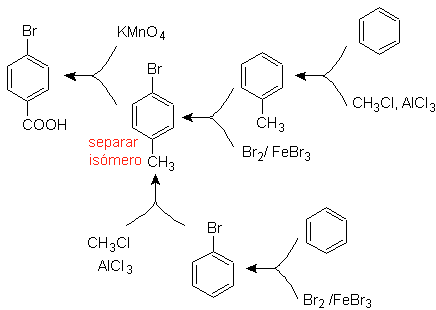
Наилучшим вариантом является тот, в котором в качестве интермедиата используется толуол, так как метильная группа слабо активирует бензольное кольцо и повышает выход образования п-бромтолуола.
При втором пути синтеза следует учитывать, что бром дезактивирует цикл, поэтому выход реакции, очевидно, будет значительно ниже, чем при первом пути. Однако надо понимать, что единого продукта в синтезе не бывает, так как будет образовываться и орто-замещенный изомер, который обязательно должен быть выделен в процессе синтеза.
Второй случай, демонстрирующий особенности электрофильного многократного замещения бензольного кольца, представляет собой синтез 4-хлор-1-нитро-2-пропилбензола (MOb. 17) из бензола.
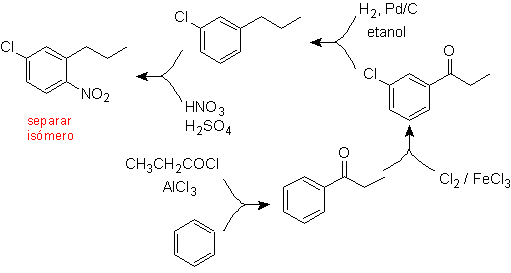
Решение (MOb 17).
В принципе существует три возможных дизамещенных предшественника, но подходит только один из них. Также в этом случае высока вероятность образования изомера 2-хлор-1-нитро-4-пропилбензола.
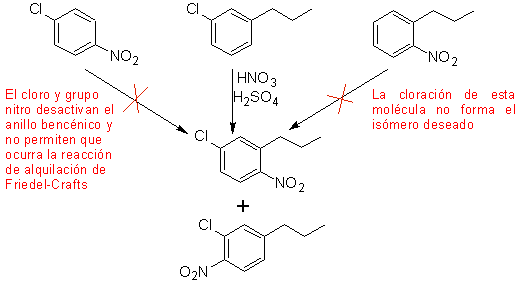
окончательный синтез
Теперь ясно, что одной из задач химика является проектирование пути синтеза, которые ведут, насколько это возможно, к образованию одного продукта с наивысшими выходами, то есть избегают образования изомеров на протяжении всего процесса. Чтобы проиллюстрировать этот аспект, мы изучим синтез следующих молекул:
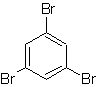
Моб. 18
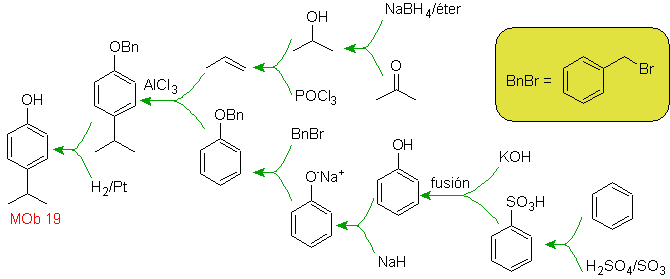
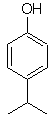
| Моб. 19
|
Решение МОБ 18
Бром ориентирован в орто-положении, а также дезактивирует бензольное кольцо, поэтому стратегия прибегает к размещению сильно активирующей группы в орто- и пара-положениях нового электрофила и после запуска реакции удалению активирующей группы из бензольного кольца.
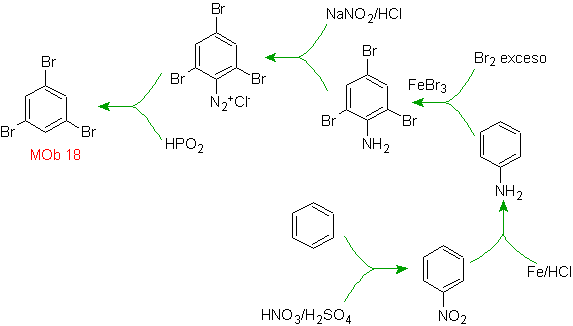
Группа –ОН является сильным активатором бензольного кольца и орто-пара-ориентации. Следовательно, мы можем превратить группу –ОН в гораздо большую группу, т. е. объемную, которая будет оказывать стерическое препятствие любому приближающемуся к кольцу электрофилу и будет ориентировать его только в пара-положение. Наконец, группа –ОН будет восстановлена, чтобы достичь молекулы-мишени.