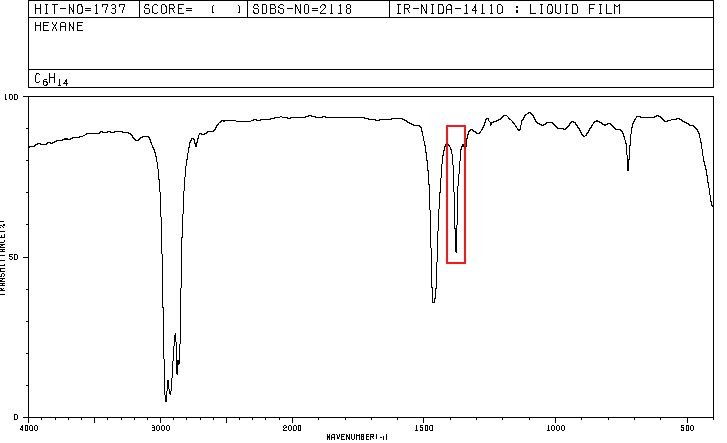
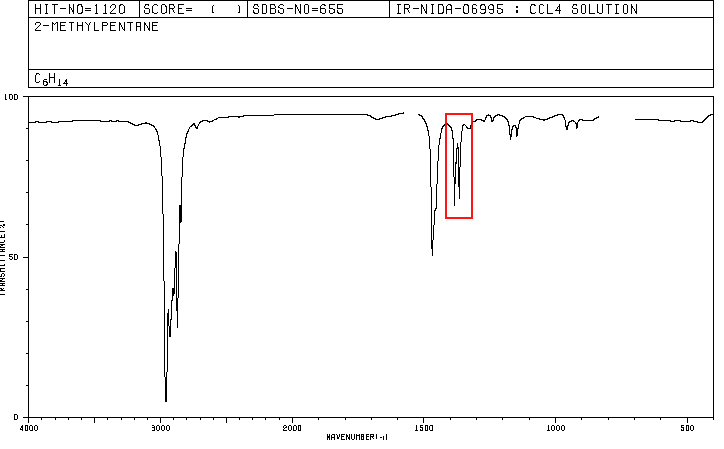
Um composto orgânico cuja composição percentual é de 83,63% de carbono e 16,37% de hidrogênio com massa molecular de 86,11, apresenta o seguinte espectro de IV.
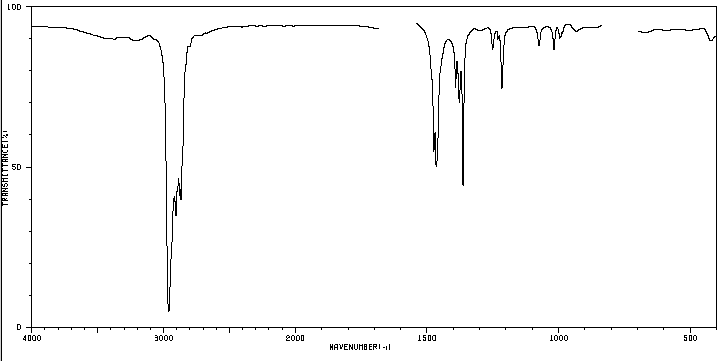
Determine a estrutura do composto.
1. Determinação da fórmula empírica
\(C:\frac{83,63}{12,01}=6,96;\;\;\; H:\frac{16,37}{1,008}= 16,24\). Dividindo pelo menor valor \(C:\frac{6.96}{6.96}=1;\;\;\;H:\frac{16.24}{6.96}=2.33\) . Multiplicando por 3 obtemos valores inteiros C:3 H:7. Portanto, a fórmula empírica é \((C_3H_7)_n\).
2. Determinação da fórmula molecular
\(n=\frac{86,11}{3\vezes 12,01+7\vezes 1,008}=2\). A fórmula molecular é: C 6 H 14
3. Determinação do índice de insaturação.
Comparando com a fórmula \(C_nH_{2n+2}\) observa-se que o alcano de 6 carbonos possui 14 hidrogênios. Portanto, nossa fórmula molecular carece de insaturações (alcano).
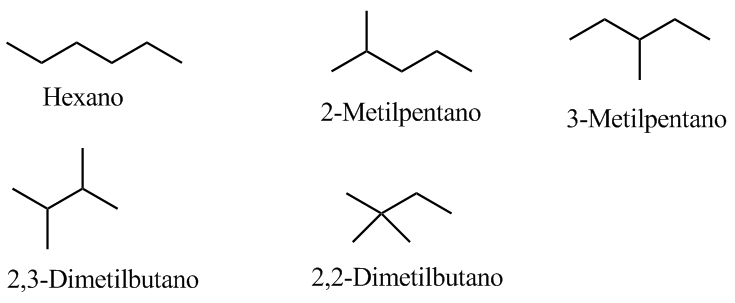
4. Escreva os possíveis isômeros.
Como é um composto saturado, não conterá ciclos nem ligações duplas.
5. Estudo do espectro para determinar a que isómero pertence.
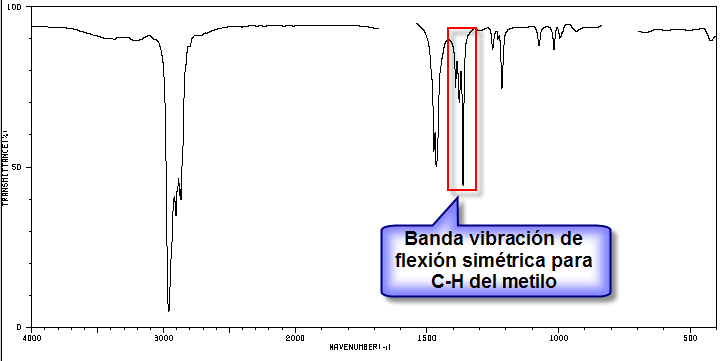
A banda indicada, devido à vibração de flexão simétrica das ligações metil CH, é dividida para os grupos isopropila e terc-butila. No caso do isopropilo, duas bandas de igual intensidade aparecem em 1380 e 1370 cm -1 . No caso do terc-butil a banda 1380 tem metade da intensidade. Como pode ser visto em nosso espectro, as duas bandas são de intensidade diferente, fato que indica a presença de um grupo terc-butila na molécula. Dos 5 isômeros propostos, apenas um apresenta esse grupo, o 2,2-dimetilbutano.
Os espectros para hexano e 2-metilpentano estão incluídos abaixo.