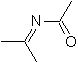
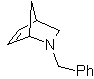
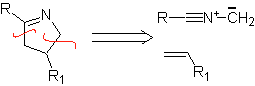
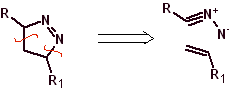
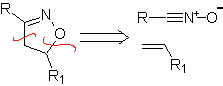
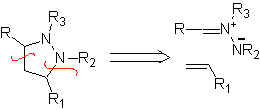
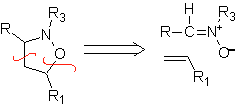
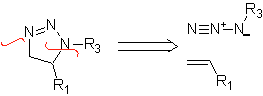
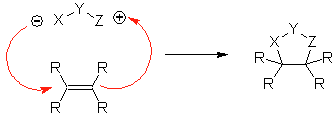
Queste reazioni formano normalmente anelli eterociclici a cinque membri, per i quali è necessaria la reazione tra un composto n1,3 dipolare e un alchene. La reazione è una [3-2] cicloaddizione. I composti 1,3-dipolari che hanno avuto il maggior utilizzo per formare eterocicli pentagonali sono:
 |  |
 |  |
 |  |
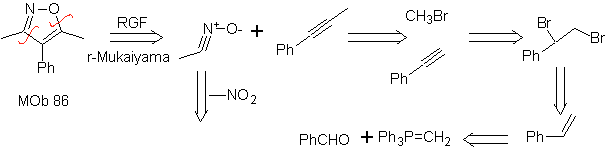
| MOb: 86
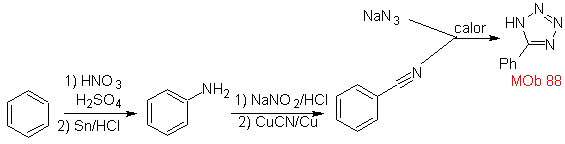
| . | MOb: 87 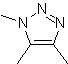 | .. | MOb: 88 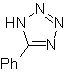 |
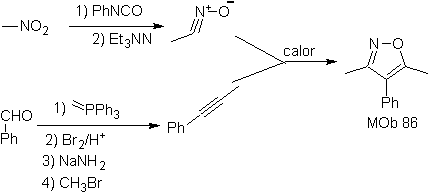
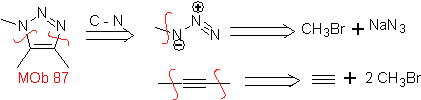
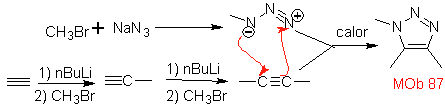
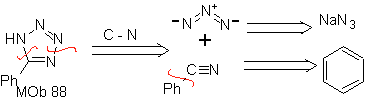
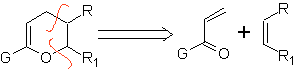
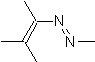
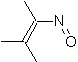
Sono buoni eterodieni, aldeidi e chetoni coniugati, 1-azadieni e 2-azadieni. Aldeidi e chetoni coniugati producono anelli piranici, la reazione è facilitata dagli acidi di Lewis o dall'aumento della pressione, nonché dalla presenza di un gruppo elettronico. attraente per l'alchene.
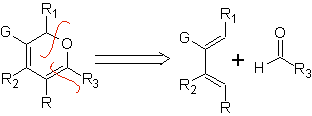
Eterodienofili più comuni nella reazione di Diels-Alder:
| | ||||||
Aldeidi, chetoni e aldeidi, se sono carenti di elettroni, reagiscono in condizioni blande, altrimenti richiedono condizioni di alta pressione e temperatura o catalizzatori di tipo acido di Lewis. Questi eterodienofili permettono la formazione di sistemi piranici, utili nella preparazione di precursori aciclici di vari farmaci, come nel caso degli antibiotici macrociclici.
 | … | 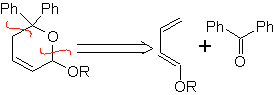 |
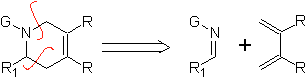 | 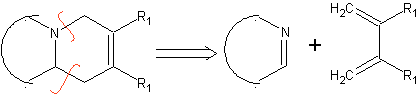 |
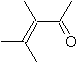 | 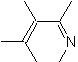 | |
| ||
 |  | |
|
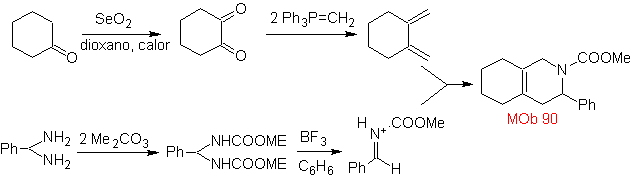
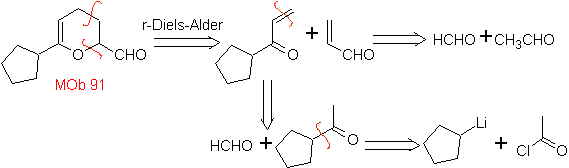
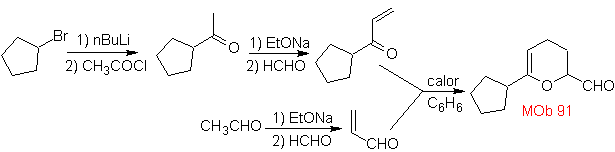
MOb 89 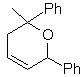 | … | MOb: 90 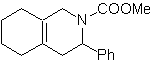 | . | MOb: 91 |
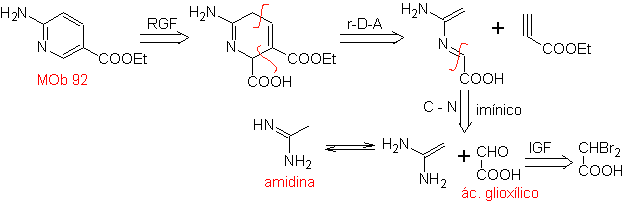
| MOb: 92
| MOb: 93
| MOb 94 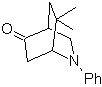 |
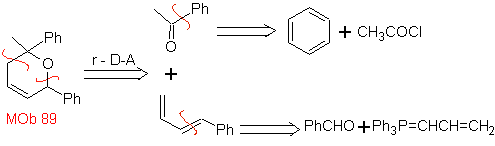
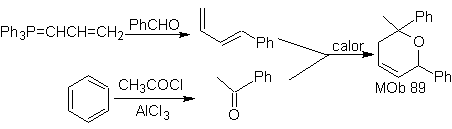
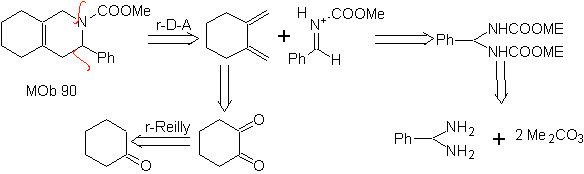
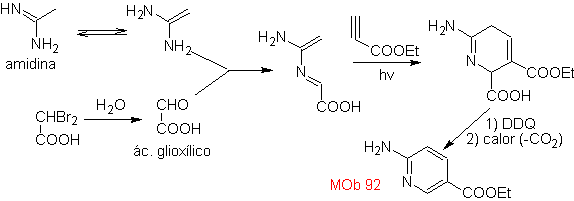
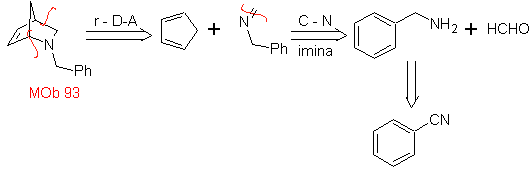
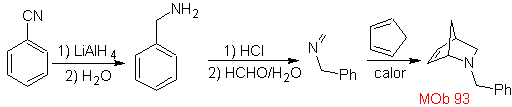
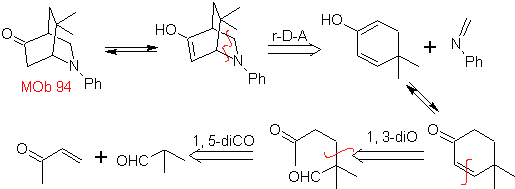
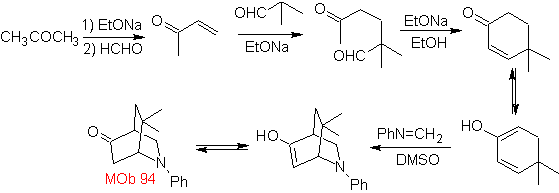
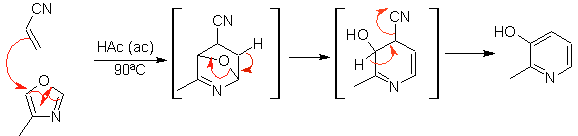
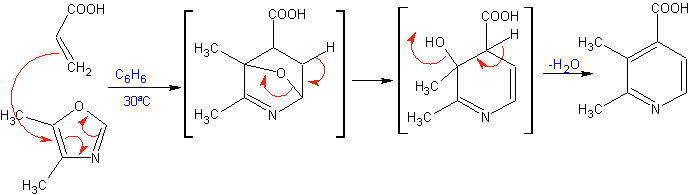
Le cicloaddizioni più studiate sono quelle che si verificano tra composti eterociclici pentagonali come gli ossazoli e alcuni dienofili, che possono essere combinati con essi mediante addizione elettrociclica e successiva eliminazione di una piccola molecola, per produrre anelli piridinici. Esempi: