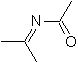
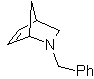
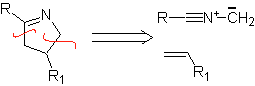
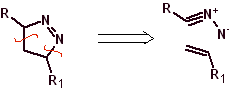
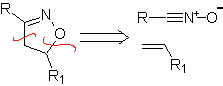
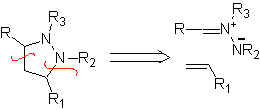
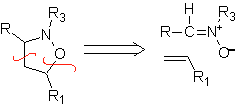
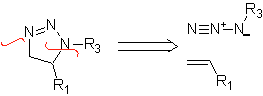
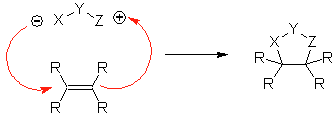
Diese Reaktionen bilden normalerweise fünfgliedrige heterocyclische Ringe, für die die Reaktion zwischen einer dipolaren n1,3-Verbindung und einem Alken notwendig ist. Die Reaktion ist eine [3-2]-Cycloaddition. Die 1,3-dipolaren Verbindungen, die am häufigsten zur Bildung von pentagonalen Heterocyclen verwendet wurden, sind:
 |  |
 |  |
 |  |
| MB: 86
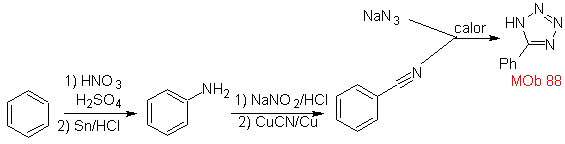
| . | MB: 87 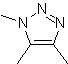 | .. | MB: 88 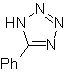 |
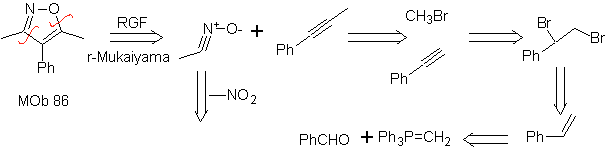
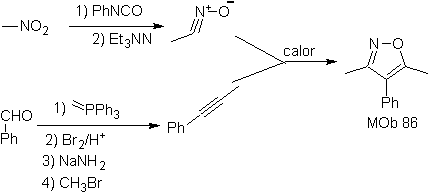
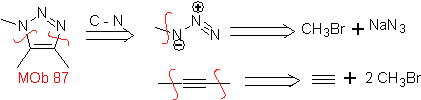
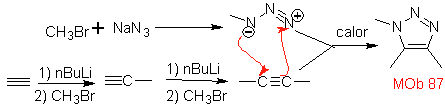
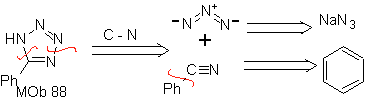
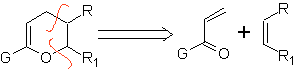
Sie sind gute Heterodiene, Aldehyde und konjugierte Ketone, 1-Azadiene und 2-Azadiene. Konjugierte Aldehyde und Ketone erzeugen Pyranringe, die Reaktion wird durch Lewis-Säuren oder erhöhten Druck sowie das Vorhandensein einer Elektronengruppe erleichtert. attraktiv für das Alken.
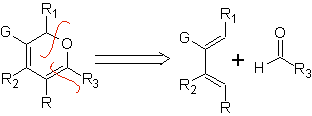
Häufigste Heterodienophile in der Diels-Alder-Reaktion:
| | ||||||
Aldehyde, Ketone und Aldehyde reagieren, wenn sie elektronenarm sind, unter milden Bedingungen, andernfalls erfordern sie Hochdruck- und Temperaturbedingungen oder Katalysatoren vom Lewis-Säure-Typ. Diese Heterodienophile ermöglichen die Bildung von Pyransystemen, die bei der Herstellung von acyclischen Vorläufern verschiedener Arzneimittel nützlich sind, wie es im Fall von makrocyclischen Antibiotika der Fall ist.
 | … | 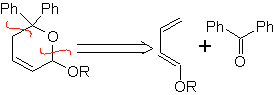 |
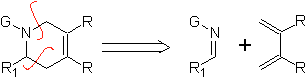 | 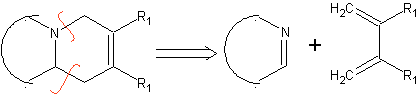 |
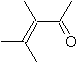 | 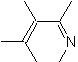 | |
| ||
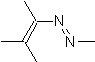 | 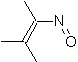 | |
|
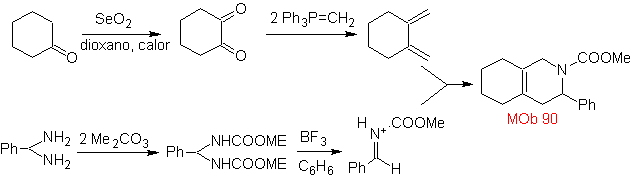
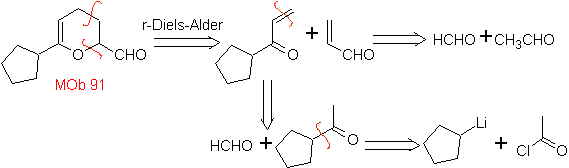
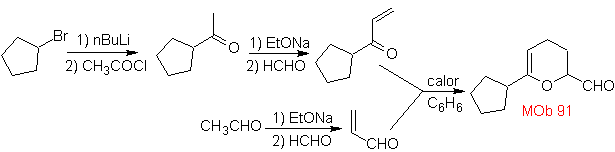
MB 89 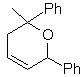 | … | MB: 90 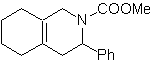 | . | MB: 91 |
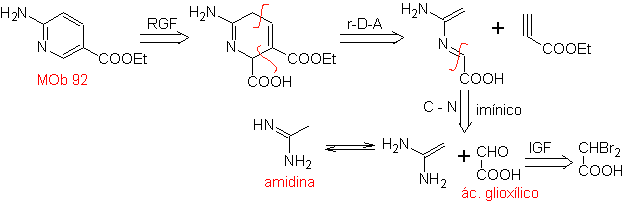
| MB: 92
| MB: 93
| MB 94 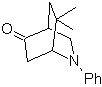 |
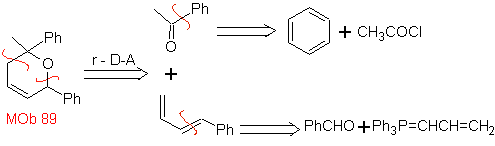
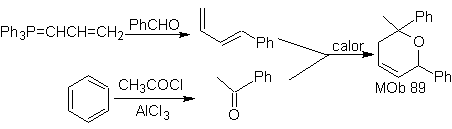
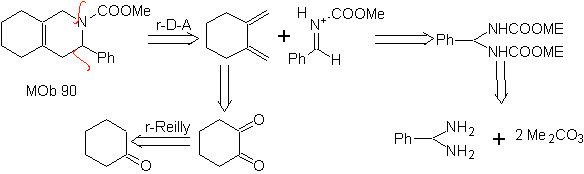
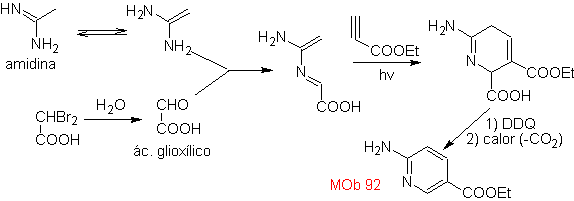
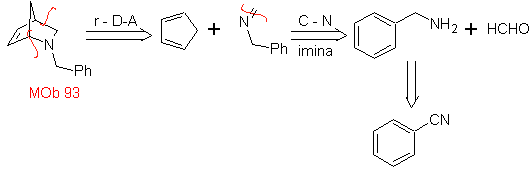
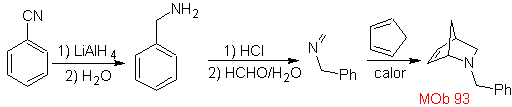
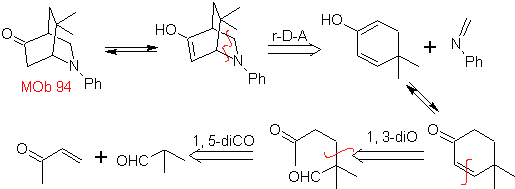
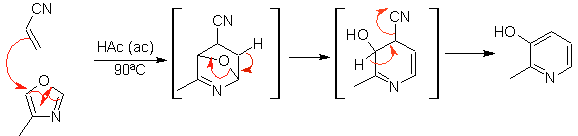
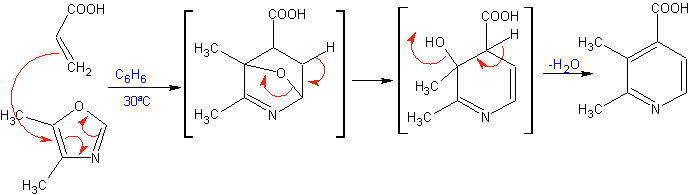
Die am besten untersuchten Cycloadditionen sind solche, die zwischen pentagonalen heterocyclischen Verbindungen wie Oxazolen und einigen Dienophilen auftreten, die mit ihnen durch elektrocyclische Addition und anschließende Eliminierung eines kleinen Moleküls kombiniert werden können, um Pyridinringe zu erzeugen. Beispiele: