Stereokimia
Stereokimia adalah studi tentang senyawa organik di ruang angkasa. Untuk memahami sifat-sifat senyawa organik, perlu mempertimbangkan ketiga dimensi spasial. Dasar stereokimia diletakkan oleh Jacobus van't Hoff dan Le Bel, pada tahun 1874, serta oleh Ernest L. Eliel pada abad ke-20. Mereka secara independen mengusulkan bahwa empat substituen pada karbon mengarah ke simpul tetrahedron, dengan karbon di pusat tetrahedron.
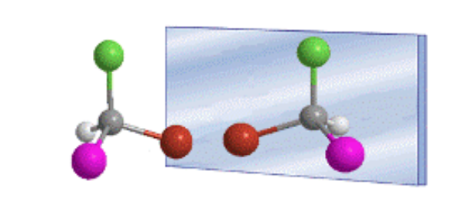
Susunan tetrahedral substituen pada karbon sp 3 memunculkan adanya dua senyawa yang mungkin, yang merupakan gambar cermin yang tidak dapat ditumpangkan, yang disebut enansiomer.
Secara umum, molekul yang berbeda dengan susunan spasial atomnya disebut stereoisomer.
Isomeria
Isomer adalah senyawa-senyawa yang memiliki rumus molekul identik tetapi berbeda dalam sifat atau susunan ikatan antara atom-atomnya atau dalam susunan atom-atomnya di ruang angkasa.
Untuk menginterpretasikan perbedaan sifat, ahli kimia di abad lalu membayangkan bahwa atom-atom dari sebuah molekul memiliki susunan spasial tertentu yang menjelaskan perilaku mereka yang berbeda.
Klasifikasi berdasarkan fungsi kimiawi, yang ditetapkan menurut perilaku senyawa, telah dikaitkan dengan keberadaan sekelompok atom dalam molekul yang disebut gugus fungsi.
Selain pentingnya gugus fungsi, terdapat perbedaan perilaku yang disebabkan oleh sedikit perbedaan dalam susunan atom-atom berbeda yang membentuk sisa molekul. Perbedaan-perbedaan ini dapat menanggapi berbagai kelas isomerisme:
isomerisme fungsi
Isomer konstitusional, yang berbeda satu sama lain karena gugus fungsinya berbeda, termasuk dalam jenis isomerisme ini.
Gugus fungsi pada kedua isomer berbeda
C2H6O _
Etanol (CH 3 -CH 2 -OH) dan dimetil eter (CH 3 -O-CH 3 )
Alkohol bereaksi dengan natrium sedangkan dengan eter tidak ada reaksi yang diamati.
Dari segi fisika, alkohol adalah cairan dengan titik didih 78,5°C, sedangkan eter adalah gas yang mencair pada suhu -23°C.
Isomerisme posisi dan/atau kerangka.
Gugus fungsi identik tetapi ditempatkan pada posisi yang berbeda pada kerangka molekul (isomer posisi).
Contoh: 2-heksanol dan 3-heksanol:
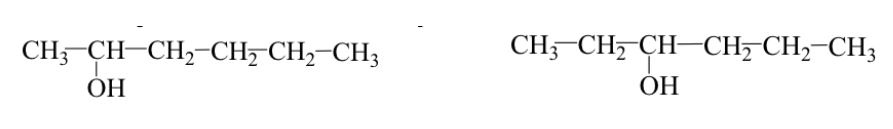
Terkadang gugus alkil memiliki susunan yang berbeda (isomer tulang punggung atau percabangan).
Contoh: 3-metil-2-pentanol dan 2-heksanol
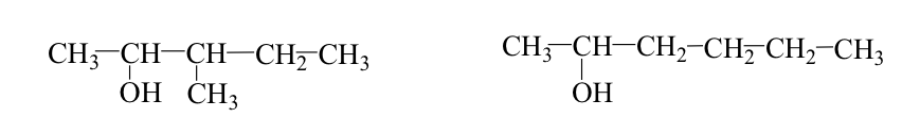
Kedua kasus dapat terjadi secara bersamaan:
Contoh: 3-metil-2-pentanol dan 3-heksanol
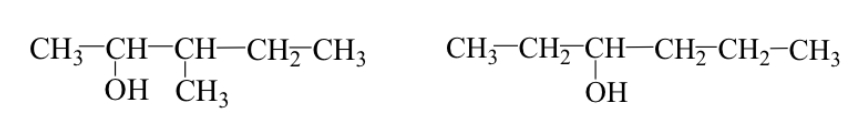
tautomerisme
Mereka adalah isomer konstitusional dari interkonversi yang mudah karena mereka berada dalam kesetimbangan yang cepat satu sama lain. Fenomena ini disebut tautomerisme dan biasanya terdiri dari sebuah atom, biasanya hidrogen, yang terletak di triad atom, dan ikatan rangkap yang berubah posisi secara bersamaan.
Contoh paling klasik adalah kesetimbangan keto-enol ( -ena untuk ikatan rangkap dan -ol untuk alkohol).
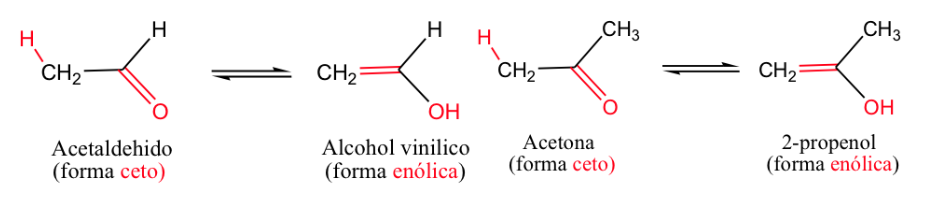
Umumnya, bentuk keton adalah yang paling stabil, tetapi ketika bentuk enol menjadi stabil (melalui ikatan hidrogen atau resonansi) kesetimbangan bergeser.
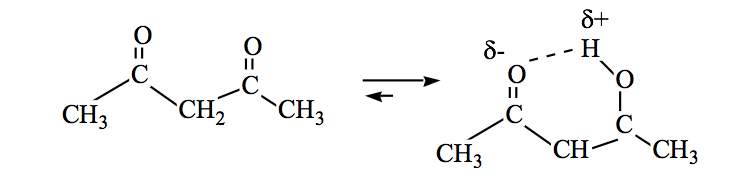
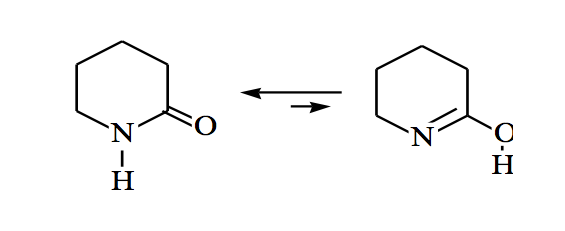
Amida juga bisa berada dalam kesetimbangan keto-enol:
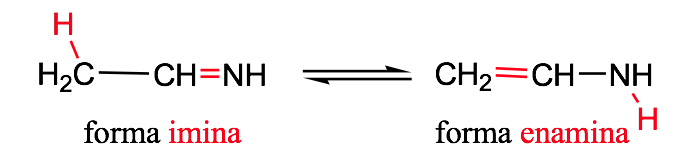
Tautomerisme imina-enamina :
nitro-aci
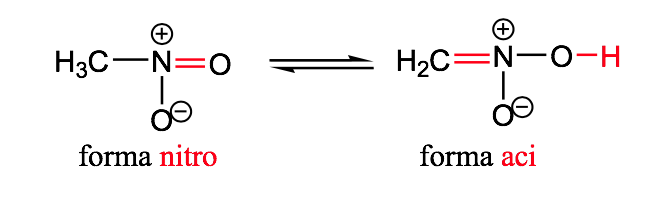
isomer geometris
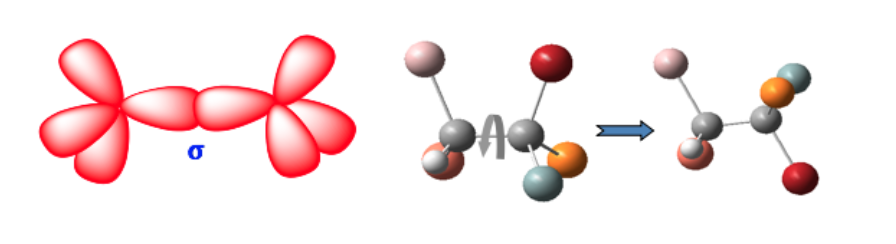
Kedua bentuk ini bukan isomer geometris karena rotasi bebas di sekitar ikatan tunggal mengubah satu bentuk menjadi bentuk lain (konformer).
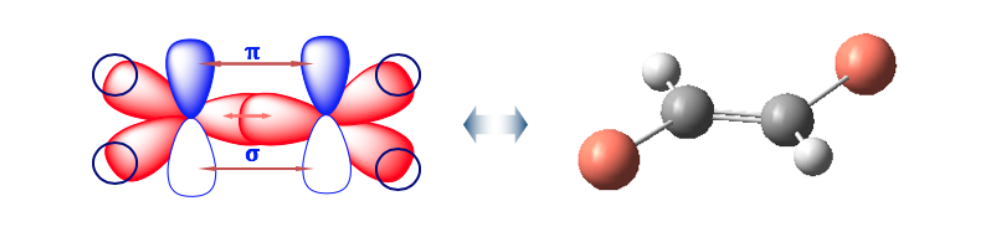
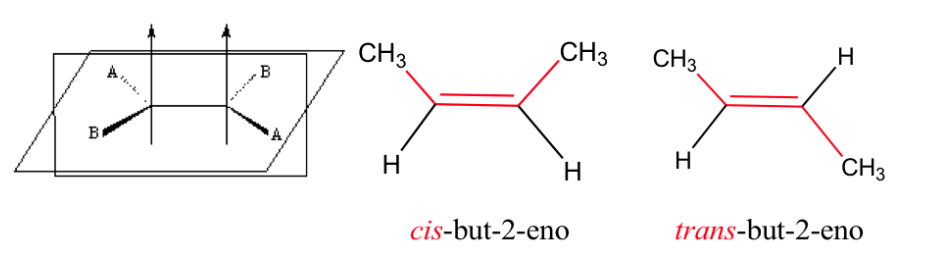
Ikatan rangkap tidak memungkinkan rotasi bebas, yang dapat menghasilkan dua struktur berbeda tergantung pada posisi grup A dan B di ruang angkasa: mereka adalah isomer geometris .
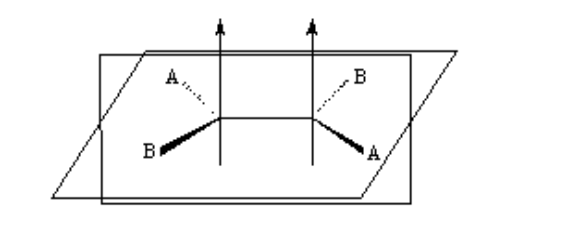
keisomeran pada alkena
Agar isomerisme geometri ada, dua syarat harus dipenuhi:
1.- Rotasi terhambat (misalnya dengan ikatan rangkap)
2.- Dua kelompok berbeda (A dan B) terpasang pada kedua sisi mata rantai
Pengaruh isomerisme geometris pada sifat fisik

Nomenklatur isomer geometris
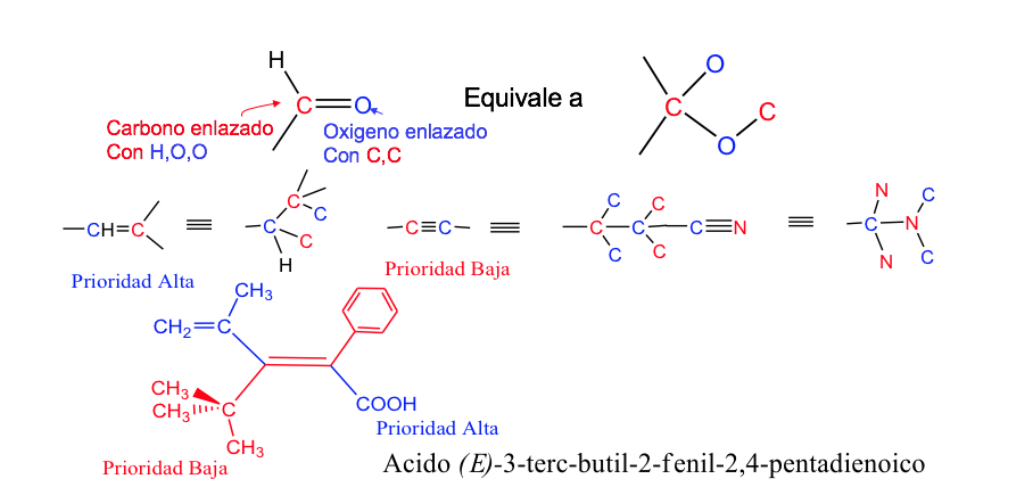
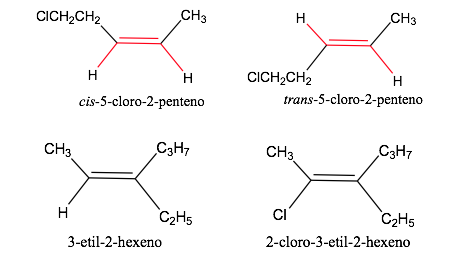 Aturan urutan atau prioritas
Aturan urutan atau prioritas
Aturan yang harus diperhitungkan untuk menetapkan urutan prioritas atau preferensi atom atau kelompok atom ditetapkan pada tahun 1956 oleh Cahn , Ingold dan Prelog dan dimodifikasi beberapa kali untuk menghindari ambiguitas.
Ketika gugus dengan prioritas tinggi terletak pada sisi yang berlawanan dari bidang yang tegak lurus terhadap molekul, isomernya disebut E.
Ketika mereka berada di sisi yang sama dari bidang ini, isomernya disebut Z.
Contoh: but-2-ena:
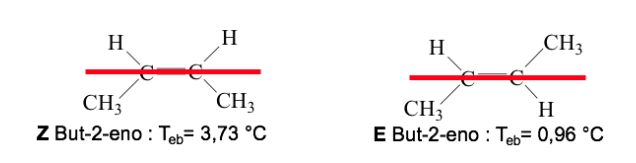
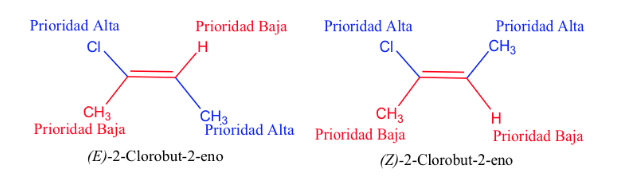
Prioritas substituen pada karbon ikatan rangkap dapat disimpulkan dari aturan berikut:
- Aturan 1:
- Jika atom yang melekat pada atom karbon yang diteliti berbeda, atom dengan nomor atom lebih tinggi memiliki prioritas daripada atom dengan nomor atom lebih rendah dan jika ada dua isotop, keduanya dipertimbangkan dalam urutan penurunan massa atom.
Contoh: Br (35)> Cl (17)> O (8)> N (7)> C (6)> H (1)
D> H dan 13 C> 12 C
Aturan 2 :
Ketika atom-atom yang melekat pada atom karbon identik (dan aturan pertama tidak berfungsi), urutannya diikuti, yaitu atom-atom yang melekat padanya dibandingkan dan, jika perlu karena mereka juga sama, atom-atom yang terikat padanya digunakan.mengikuti, dll., mengingat bahwa jika atom-atomnya sama tetapi dalam nomor yang berbeda, substituen dengan lebih banyak atom dengan peringkat yang lebih tinggi diprioritaskan.
Contoh : -CH 2 -OH> -CH 3 karena O> H
-CH 2 -Br> -CH 2 -OH karena Br> OH
-CH 2 -CH 3> -CH 3 karena C> H
Aturan 3:
Ikatan rangkap dan rangkap tiga diperlakukan seolah-olah mereka tunggal, dua kali lipat atau tiga kali lipat atom dalam rantai, masing-masing.
. Isomerisme siklus dan sistem kompleks.
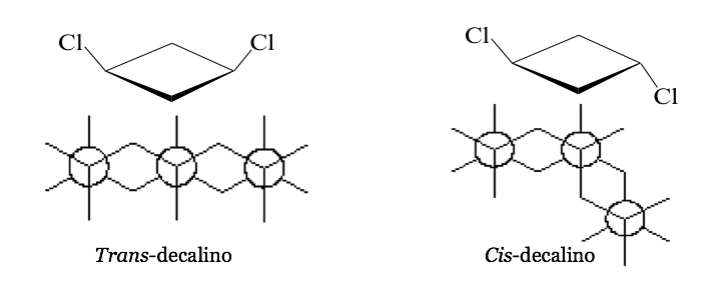
Dalam beberapa molekul siklik simetris (setidaknya tersubstitusi), atom-atom dari siklus menentukan bidang. Satu substituen terletak pada salah satu sisi bidang ini sementara substituen lainnya mungkin terletak pada sisi yang sama atau sisi yang berlawanan.
cis- 1,3-Dichlorocyclobutane trans- 1,3-Dichlorocyclobutane
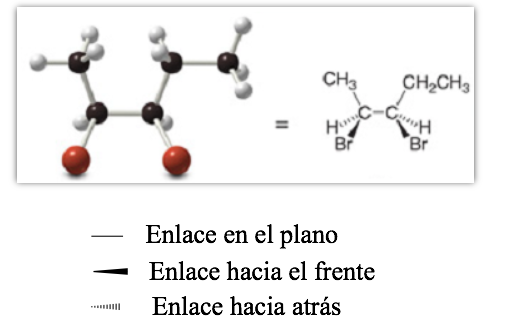
Representasi proyektif (CRAM)
representasi perspektif
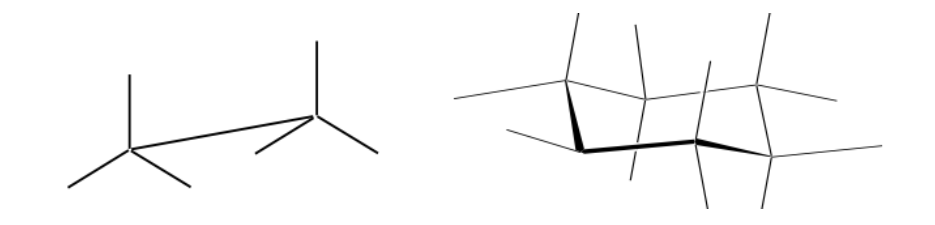
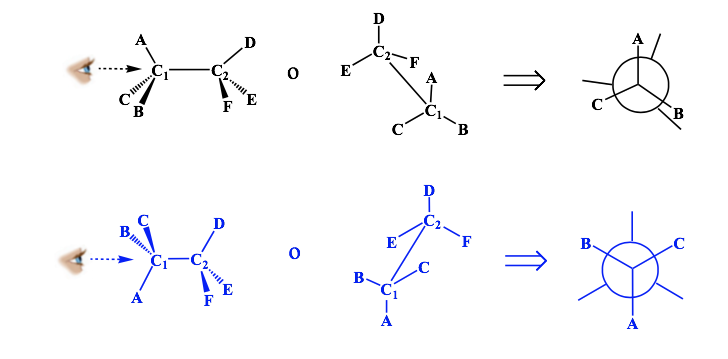
representasi Newman
Proyeksi Newman adalah bentuk representasi dua dimensi yang berguna untuk memvisualisasikan konformasi dalam ikatan tunggal karbon-karbon dalam molekul organik.
Representasi nelayan.
Proyeksi Fisher adalah cara standar menggambar atom karbon tetrahedral dan substituennya dalam dua dimensi.
Dalam proyeksi ini setiap karbon tetrahedral direpresentasikan sebagai persilangan di mana garis horizontal diarahkan ke luar kertas dan garis vertikal ke dalam.
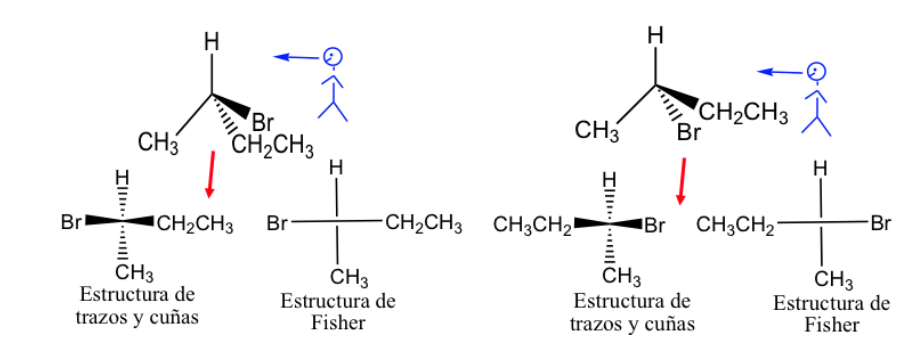
Representasi Fisher dapat dilakukan dengan menandai ikatan yang ada di depan bidang dengan garis tebal dan yang terletak di belakang dengan garis putus-putus, tetapi umumnya tautan yang berbeda disajikan dengan garis normal, meskipun dipahami bahwa substituen diwakili oleh kanan dan kiri garis vertikal berada di atas bidang representasi dan yang diwakili di atas dan di bawah berada di bawah bidang itu.
Secara umum, rantai karbon disajikan secara vertikal, menempatkan karbon yang paling teroksidasi di atas.
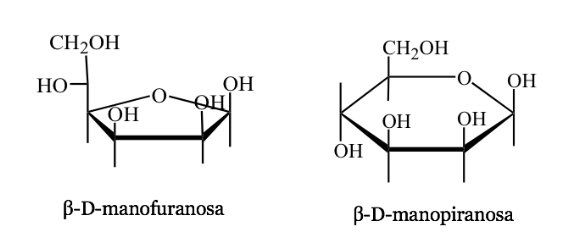
Representasi Harwoth
- Ini adalah representasi perspektif dari bentuk siklik molekul gula dengan 5 atau 6 atom (furanosa, piranosa).
- Misalnya:
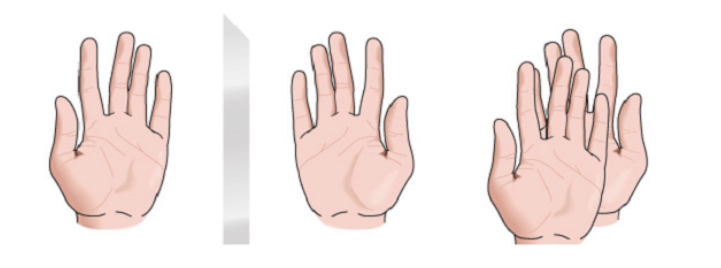
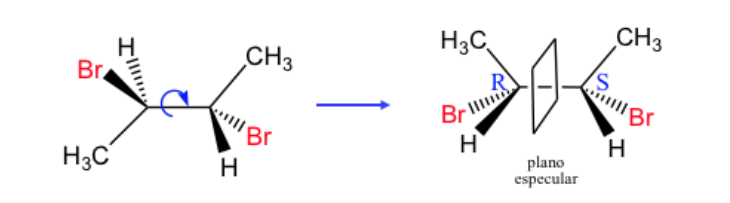
kiralitas
Sosok geometris apa pun, atau kelompok titik mana pun, yang bayangannya di cermin bidang, yang diwujudkan secara ideal, tidak dapat dibuat bertepatan dengan dirinya sendiri, disebut kiral. Beberapa molekul seperti tangan. Kiri adalah bayangan cermin dari kanan tetapi tidak dapat ditumpangkan dan oleh karena itu tidak identik. Mereka disebut kiral .
Ada molekul lain yang mirip dengan sepasang kaus kaki. Kaus kaki adalah bayangan cermin satu sama lain dan juga dapat ditumpangkan.
Molekul atau objek yang dapat ditumpangkan pada bayangan cerminnya disebut akiral .
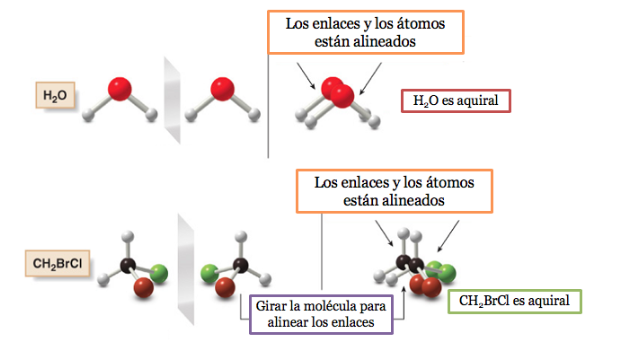
Jika sebuah molekul memiliki bidang simetri, itu adalah sistem akiral.
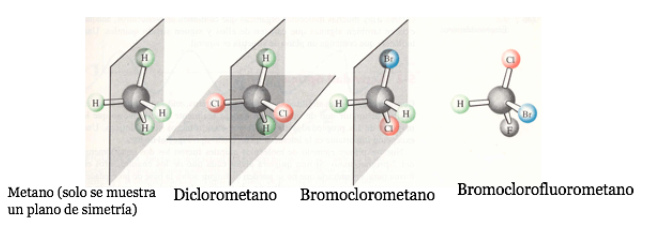
Molekul kiral ada dalam dua bentuk stereoisomer yang disebut enantiomer . Ini adalah objek yang tidak dapat ditumpangkan dengan bayangan cerminnya.
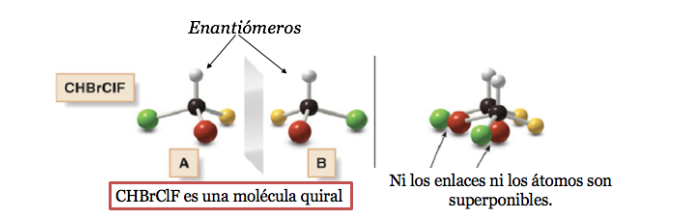
Atom karbon yang terikat pada 4 substituen berbeda disebut karbon asimetris . Namun, keberadaannya bukanlah jaminan kiralitas (seperti yang akan kita lihat nanti). Juga disebut karbon stereogenik atau stereocenter.
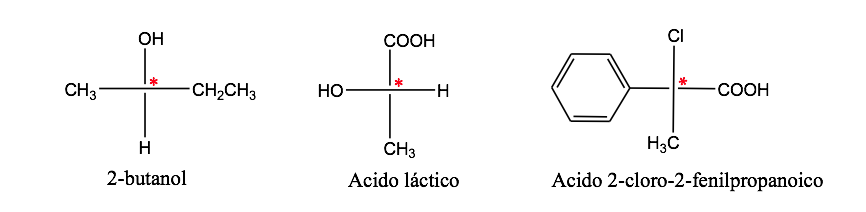
isomerisme optik
Sifat fisik dari dua enansiomer adalah identik: keduanya memiliki titik didih dan titik leleh yang sama, kelarutan yang sama, densitas yang sama, indeks bias yang sama, konduktivitas yang sama...dll.
Aktivitas optik pasangan enansiomer adalah sifat karakteristik untuk membedakannya.
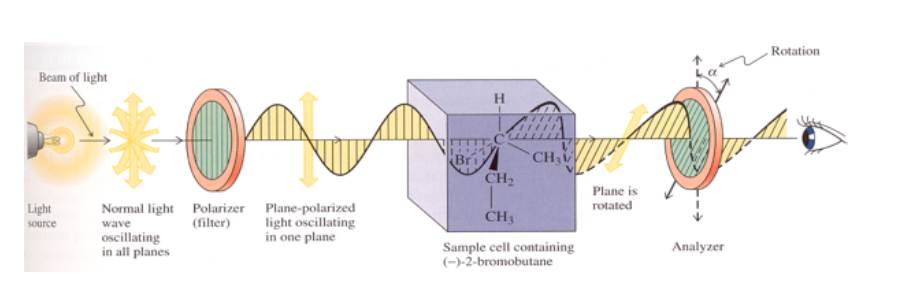
Jika zat tersebut tidak aktif secara optik, tidak ada perubahan pada bidang getaran dari cahaya terpolarisasi yang dipancarkan.
Jika zat memiliki aktivitas optik, rotasi ke derajat bidang getaran dari cahaya terpolarisasi yang dipancarkan diamati.
Jika rotasi bidang cahaya ke kanan (searah jarum jam), zat tersebut bersifat dextrorotatory dan nilai α diberi tanda positif.
Jika rotasi ke kiri (berlawanan arah jarum jam), zat tersebut berarah kiri dan α diberi tanda negatif.
Rotasi spesifik molekul aktif optik adalah konstanta fisik karakteristik molekul itu.

Rotasi spesifik beberapa senyawa kiral
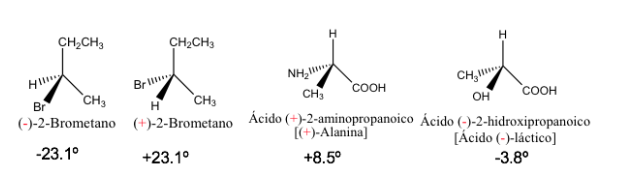
Enansiomer murni memiliki nilai rotasi spesifik yang sama tetapi dengan tanda yang berlawanan.
Oleh karena itu, rotasi optik yang dihasilkan dari campuran enansiomer 1:1 adalah nol, yaitu tidak aktif secara optik. Jenis campuran ini disebut campuran rasemat atau rasemat .
Penamaan konfigurasi absolut dari pusat stereogenik didasarkan pada aturan prioritas yang sama yang dikembangkan oleh Cahn, Ingold dan Prelog .
Aturan-aturan ini memungkinkan penamaan dan deskripsi pengaturan ruang substituen pada pusat stereogenik, terlepas dari tanda rotasi optik molekul.
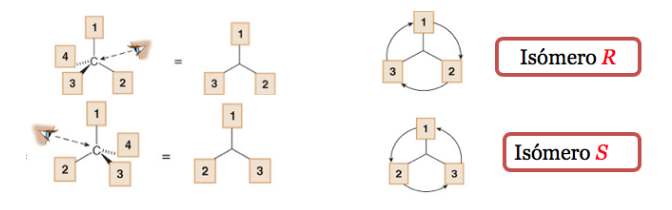
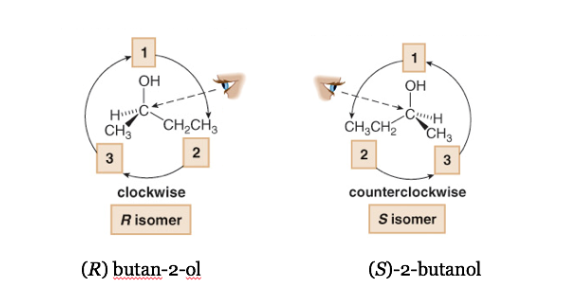
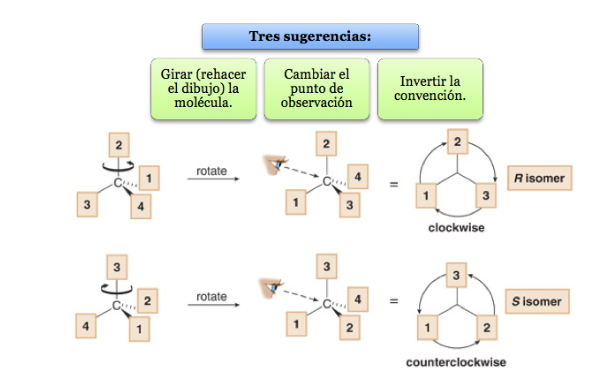
Substituen dengan prioritas terendah terletak sejauh mungkin dari pengamat.
Jika langkah dari 1 ke 2 ke 3 dilakukan searah jarum jam, pusat kiralnya adalah R (rektus, Latin, kanan).
Jika langkah 1 sampai 2 sampai 3 dilakukan berlawanan arah jarum jam, maka konfigurasi pusat kiral disebut S (sinister, latin, left).
Dalam tata nama sistematis, R atau S ditambahkan dalam tanda kurung sebagai awalan nama senyawa kiral.
Penting untuk diingat bahwa simbol R dan S tidak menunjukkan korelasi apapun dengan tanda α .
Apa yang harus dilakukan ketika sebuah molekul tidak berorientasi sehingga kelompok prioritas terendah berada jauh?
Suatu senyawa dengan n pusat stereogenik memiliki maksimum 2 n stereoisomer.
Contoh:
Senyawa dengan dua pusat stereogenik memiliki maksimal 4 stereoisomer.
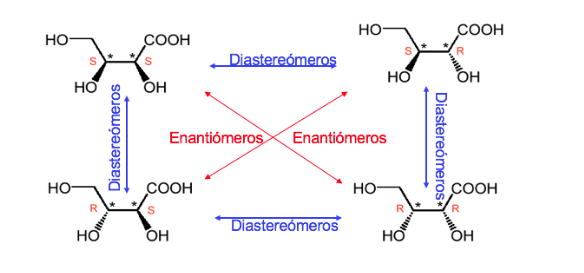
Setiap stereoisomer yang molekulnya bukan kiral meskipun memiliki pusat stereogenik disebut bentuk atau senyawa meso .
Senyawa dengan dua karbon asimetris didominasi seperti ketika dua karbon memiliki konfigurasi absolut yang sama dan tidak seperti pada kasus sebaliknya.
senyawa erythro dan threo
Ketika dua karbon memiliki setidaknya dua substituen yang identik, penunjukan threo dan erythro dapat digunakan.
Pasangan eritro enansiomer adalah pasangan yang kelompok identiknya dapat ditempatkan pada posisi gerhana.
Tidak ada hubungan langsung antara tata nama R dan S dan tata nama Erythro/Treo.
Ketika dua karbon memiliki tiga substituen yang identik, bentuk erythro adalah meso karena menghadirkan bidang simetri.
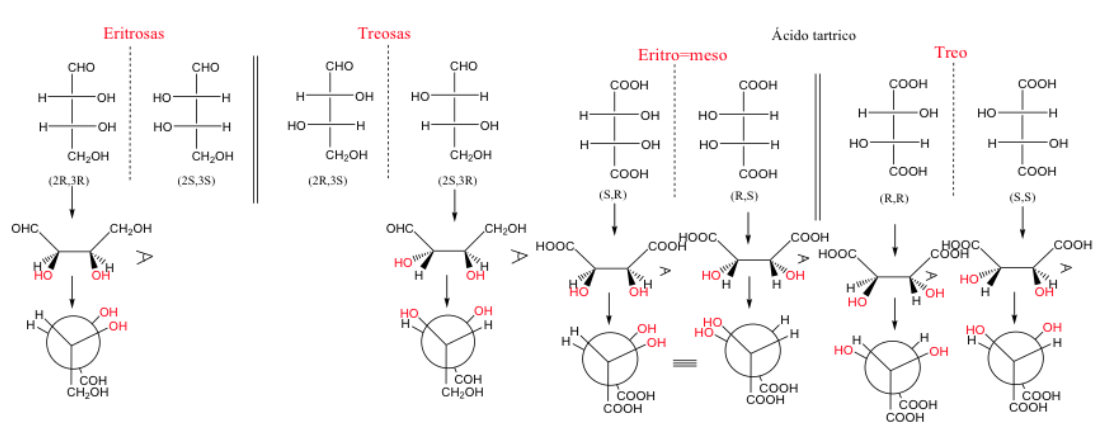
Molekul disebut erythro ketika, dalam representasi Fischer, kelompok yang sama atau serupa berada di sisi yang sama.
Molekul adalah tiga jika kelompok-kelompok ini berada di sisi yang berlawanan.
(umumnya digunakan untuk gula (osas))
Ini adalah nomenklatur yang mendahului tata nama R dan S.
Gula diberi nama D ketika, dalam proyeksi Fischer (dengan karbon paling teroksidasi terletak di atas), hidroksil yang terkait dengan karbon asimetris bernomor tertinggi ada di sebelah kanan.
Enansiomernya akan disebut L dan akan memiliki OH yang setara di sebelah kiri.
Glukosa dan fruktosa dalam bentuk alaminya ada sebagai D.
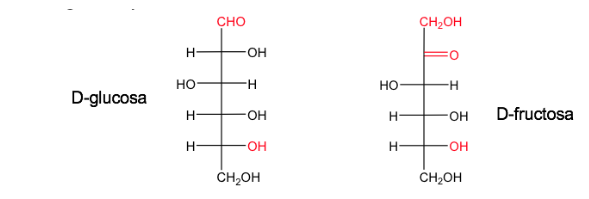
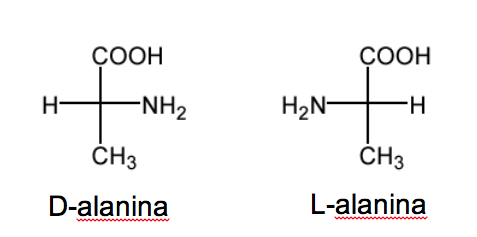
Nomenklatur D/L juga digunakan dalam rangkaian asam amino.
RCH( NH2 )COOH.
Dalam gula nomenklatur ini tergantung pada posisi hidroksil. Dalam hal ini posisi gugus amino yang menentukan nomenklatur. Ketika dalam proyeksi Fisher (dengan karbon paling teroksidasi di atas) gugus NH 2 berada di sebelah kanan, etereoisomernya adalah D dan enansiomernya adalah L .
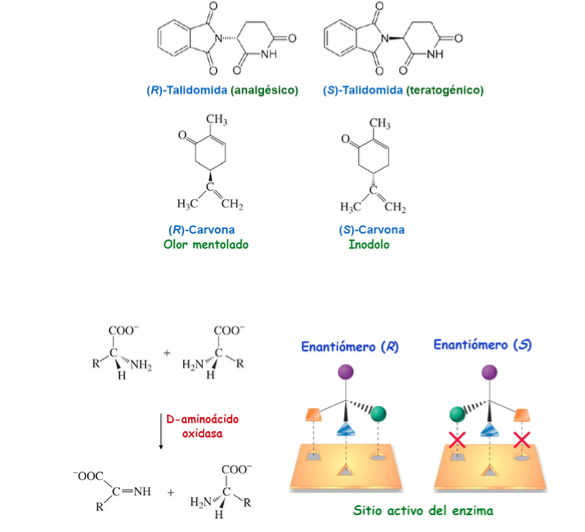
Pentingnya kiralitas
Sumber untuk memperluas pencarian pengetahuan:
1) Juaristi E. “Pengantar stereokimia dan analisis konformasi”. CINVESTAV, Meksiko, 1988 Juaristi E. . CINVESTAV, Meksiko, 1994.
2) Neil SI “Kimia Organik Fisik” Longman, Milan, 1995.
3) March J., “Kimia Organik Tingkat Lanjut” John Wiley & Sons, New York, 1992 4) Jones RAY “Kimia Organik Fisik dan Mekanistik”, ke-2. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB dan Hoffmann R. “The Conservation of Orbital Symmetry”, Academic Press, New York, 1979.
6) Carpenter BK “Penentuan Mekanisme Reaksi Organik”, John Wiley & Sons, New York, 1984 .









