Стереохимия
Стереохимия — это изучение органических соединений в космосе. Чтобы понять свойства органических соединений, необходимо учитывать все три пространственных измерения. Основы стереохимии были заложены Якобусом Вант-Гоффом и Ле Белем в 1874 году, а также Эрнестом Л. Элиэлем в 20 веке. Они независимо друг от друга предположили, что четыре заместителя углерода указывают на вершины тетраэдра, а углерод находится в центре тетраэдра.
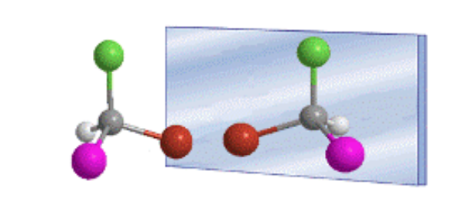
Тетраэдрическое расположение заместителей на углероде sp 3 приводит к существованию двух возможных соединений, которые являются несовместимыми зеркальными отображениями, называемыми энантиомерами.
В общем случае молекулы, различающиеся пространственным расположением атомов, называются стереоизомерами.
Изомерия
Изомеры – это соединения, имеющие идентичные молекулярные формулы, но отличающиеся характером или расположением связей между их атомами или расположением атомов в пространстве.
Чтобы интерпретировать различия в свойствах, химики прошлого века представили себе, что атомы молекулы имеют определенное пространственное расположение, объясняющее их различное поведение.
Классификация по химической функции, установленная в соответствии с поведением соединений, связана с наличием в молекуле группы атомов, называемой функциональной группой.
В дополнение к важности функциональной группы существует разница в поведении, вызванная небольшими различиями в расположении различных атомов, составляющих остальную часть молекулы. Эти различия могут соответствовать разным классам изомерии:
функциональная изомерия
К этому типу изомерии относятся конституциональные изомеры, которые отличаются друг от друга тем, что их функциональные группы различны.
Функциональная группа в обоих изомерах различна.
C2H6O _
Этанол (CH 3 -CH 2 -OH) и диметиловый эфир (CH 3 -O-CH 3 )
Спирт реагирует с натрием, а с эфиром реакции не наблюдается.
С физической точки зрения спирт — это жидкость с температурой кипения 78,5°С, а эфир — газ, сжижающийся при -23°С.
Изомерия положения и/или скелета.
Функциональные группы идентичны, но расположены в разных положениях на молекулярном скелете (позиционные изомеры).
Пример: 2-гексанол и 3-гексанол:
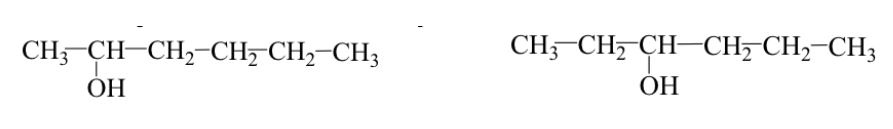
Иногда алкильная группа имеет другое расположение (изомеры основной цепи или разветвления).
Пример: 3-метил-2-пентанол и 2-гексанол.
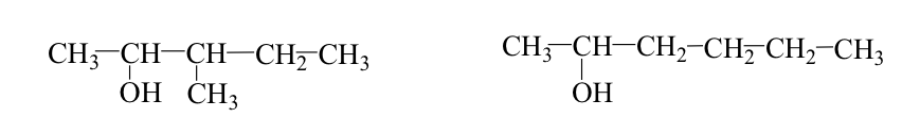
Оба случая могут происходить одновременно:
Пример: 3-метил-2-пентанол и 3-гексанол.
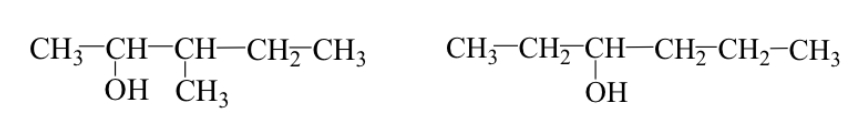
таутомерия
Они представляют собой конституциональные изомеры, легко взаимопревращающиеся, поскольку находятся в быстром равновесии друг с другом. Это явление называется таутомерией и обычно состоит из атома, обычно водорода, находящегося в триаде атомов, и одновременного изменения положения двойной связи.
Наиболее классическим примером является кето-енольное равновесие ( -ен для двойной связи и -ол для спирта).
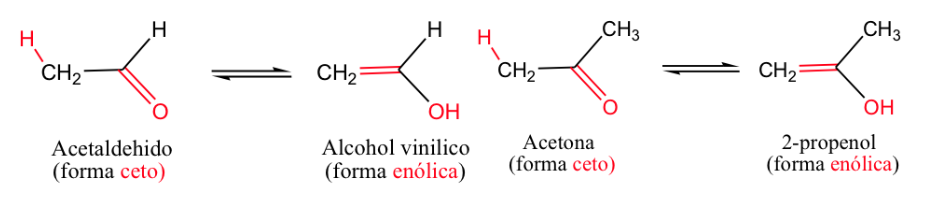
Как правило, кетоновые формы наиболее стабильны, но когда енольная форма стабилизируется (за счет водородных связей или резонанса), равновесие смещается.
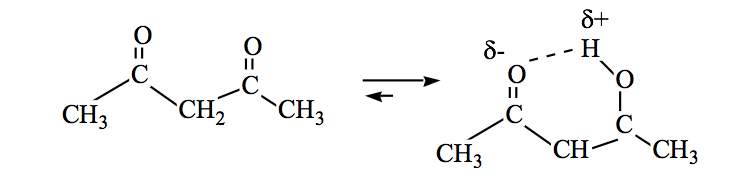
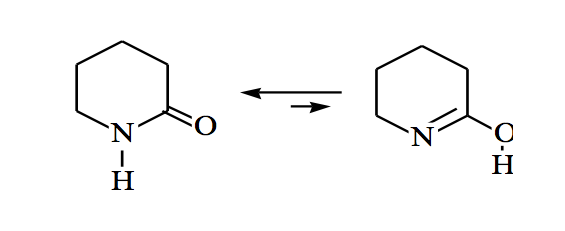
Амиды также могут находиться в кето-енольном равновесии:
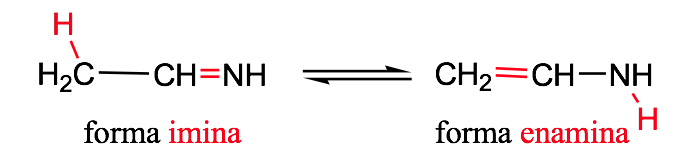
Имин-енаминная таутомерия:
нитрокислота
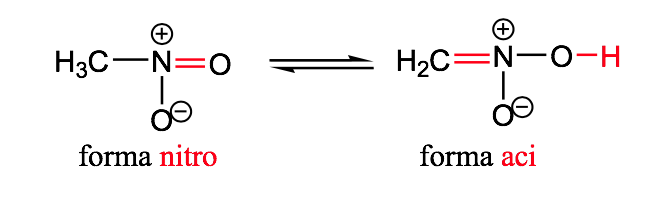
геометрическая изомерия
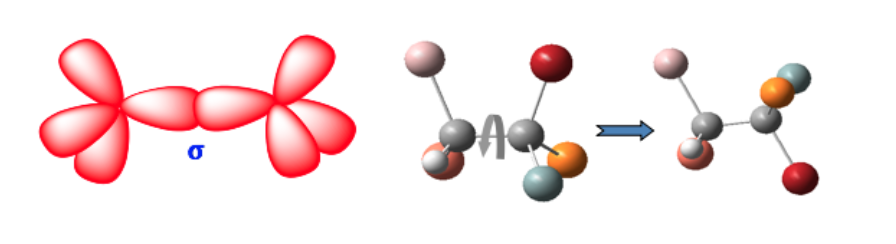
Эти две формы не являются геометрическими изомерами, поскольку свободное вращение вокруг простой связи превращает одну форму в другую (конформеры).
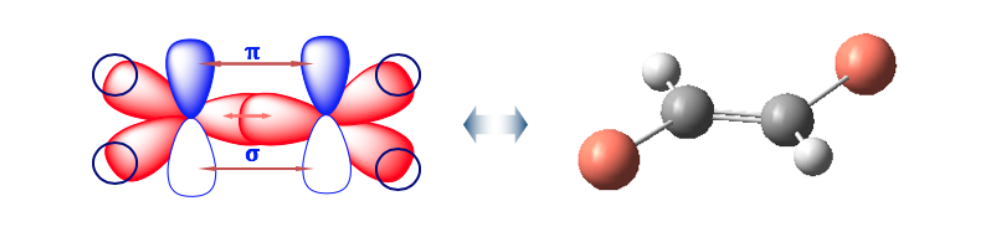
Двойная связь не допускает свободного вращения, которое может генерировать две разные структуры в зависимости от положения групп А и В в пространстве: они являются геометрическими изомерами .
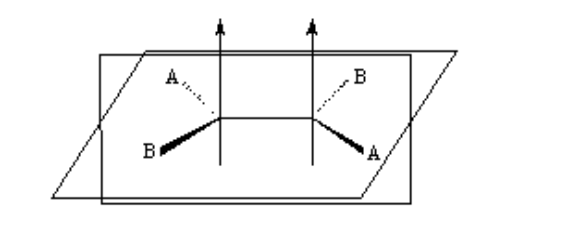
изомерия в алкенах
Для существования геометрической изомерии необходимо выполнение двух условий:
1.- Затрудненное вращение (например, двойной связью)
2.- Две разные группы (A и B), прикрепленные к обеим сторонам звена.
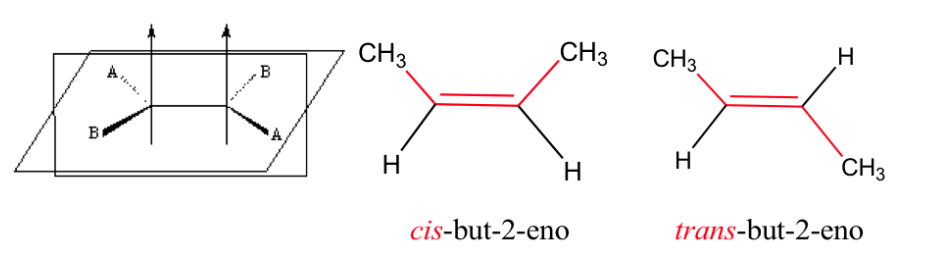
Влияние геометрической изомерии на физические свойства

Номенклатура геометрических изомеров
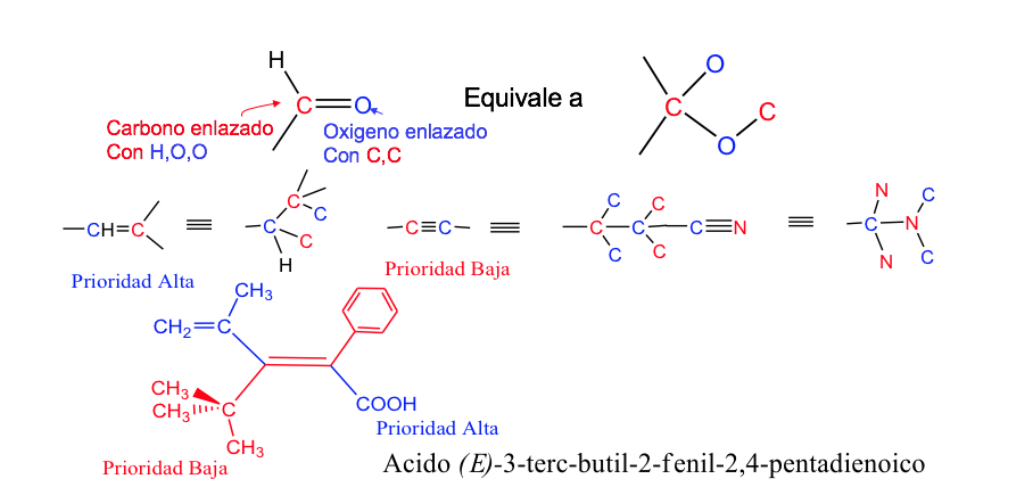
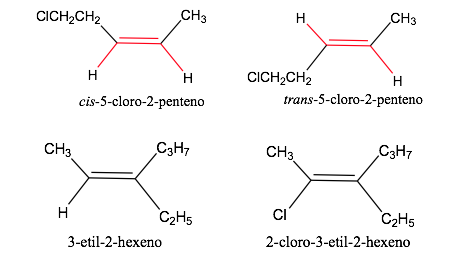 Правила последовательности или приоритета
Правила последовательности или приоритета
Правила, которые необходимо учитывать при установлении порядка приоритета или предпочтения атомов или групп атомов, были установлены в 1956 году Каном , Ингольдом и Прелогом и несколько раз изменялись во избежание двусмысленности.
Когда высокоприоритетные группы лежат на противоположных сторонах плоскости, перпендикулярной молекуле, изомер называется Е.
Когда они находятся на одной стороне этой плоскости, изомер называется Z.
Пример: бут-2-ен:
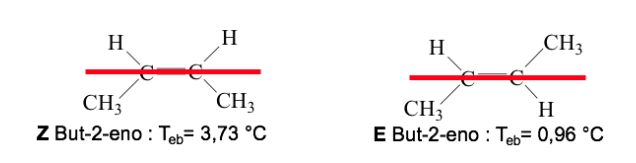
Приоритет заместителей у атомов углерода двойной связи можно вывести из следующих правил:
- Правило 1:
- Если атомы, присоединенные к исследуемому атому углерода, различны, приоритет имеют атомы с более высоким атомным номером над атомами с более низким атомным номером, а если имеется два изотопа, то они рассматриваются в порядке убывания атомной массы.
Пример: Br (35)> Cl (17)> O (8)> N (7)> C (6)> H (1)
Д> Н и 13 С> 12 С
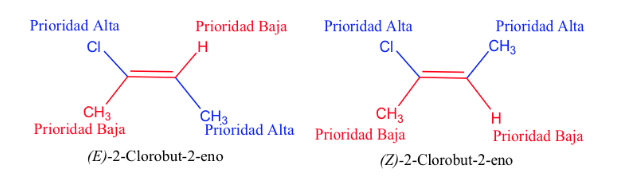
Правило 2 :
Когда атомы, присоединенные к атому углерода, идентичны (и первое правило не работает), соблюдается последовательность, то есть сравниваются присоединенные к ним атомы и, если необходимо, поскольку они также были равны, присоединенные к ним атомы используются следующие и т. д., принимая во внимание, что если атомы одинаковые, но в другом количестве, приоритет имеет заместитель с большим количеством атомов более высокого ранга.
Пример: -CH 2 -OH> -CH 3 , потому что O> H
-CH 2 -Br> -CH 2 -OH, поскольку Br> OH
-СН 2 -СН 3> -СН 3 , потому что С> Н
Правило 3:
Двойные и тройные связи рассматриваются как одинарные, соответственно удваивая или утраивая число атомов в цепи.
. Изомерия циклов и сложных систем.
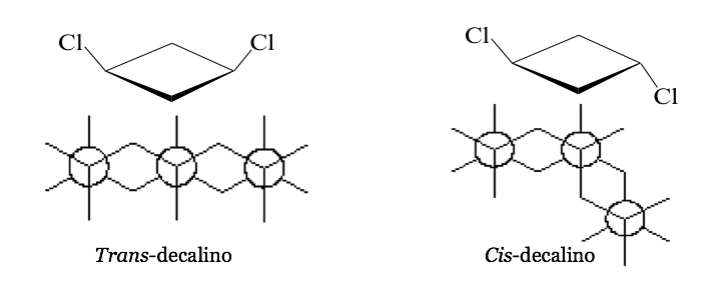
В некоторых симметричных (по крайней мере двузамещенных) циклических молекулах атомы цикла определяют плоскость. Один заместитель лежит на одной стороне этой плоскости, а другой может лежать на той же стороне или на противоположной стороне.
цис -1,3-дихлорциклобутан транс -1,3-дихлорциклобутан
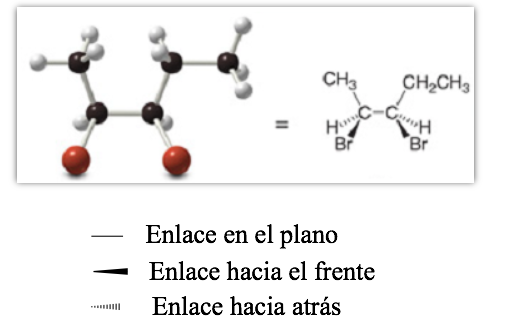
Проективное представление (CRAM)
перспективное представление
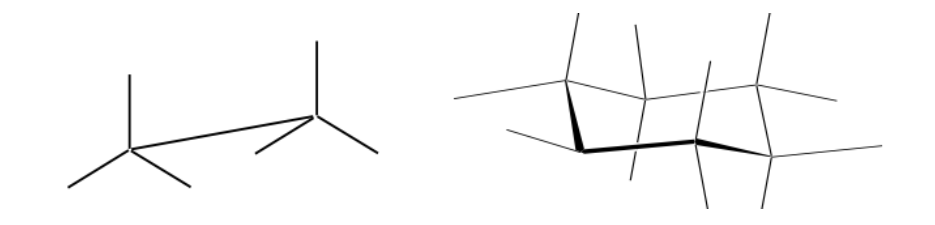
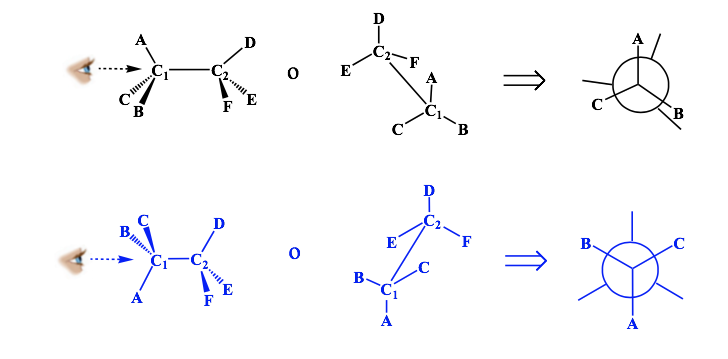
Представление Ньюмана
Проекция Ньюмена — это форма двумерного представления, полезная для визуализации конформаций одинарной углерод-углеродной связи в органической молекуле.
Представление Фишера.
Проекция Фишера — это стандартный способ изображения тетраэдрических атомов углерода и их заместителей в двух измерениях.
В этой проекции каждый тетраэдрический углерод представлен в виде креста, в котором горизонтальные линии направлены наружу от бумаги, а вертикальные внутрь.
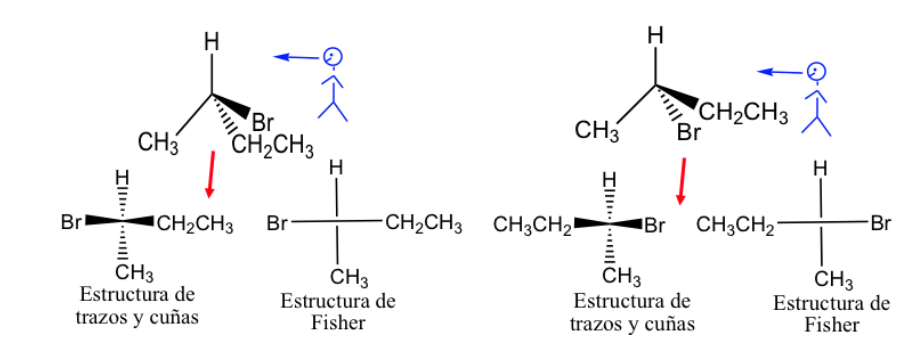
Представление Фишера можно выполнить, пометив связи, расположенные перед плоскостью, толстой линией, а те, которые расположены позади, — пунктирной линией, но обычно различные связи представляются нормальными линиями, хотя следует понимать, что заместители, представленные для правая и левая часть вертикальной линии находится над плоскостью представления, а те, что представлены выше и ниже, находятся ниже этой плоскости.
По общему правилу углеродная цепь представлена вертикально, так что наиболее окисленный углерод находится наверху.
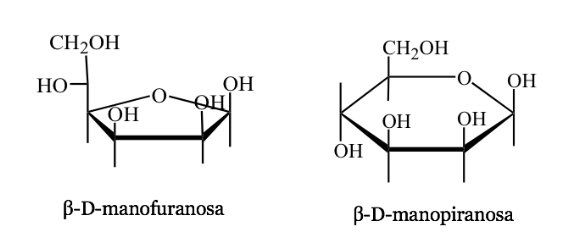
Представительство Харвота
- Это перспективное представление циклических форм молекул сахара с 5 или 6 атомами (фуранозы, пиранозы).
- Например:
хиральность
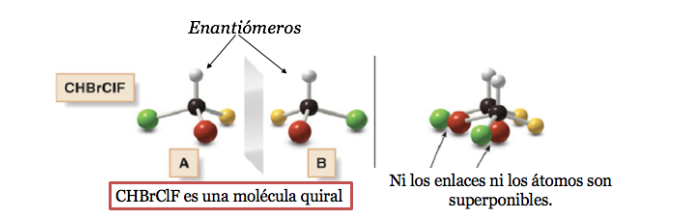
Любая геометрическая фигура или любая группа точек, изображение которых в идеально реализованном плоском зеркале не может совпадать с самой собой, называется хиральной. Некоторые молекулы похожи на руки. Левое является зеркальным отражением правого, но они не накладываются друг на друга и, следовательно, не идентичны. Они называются хиральными .
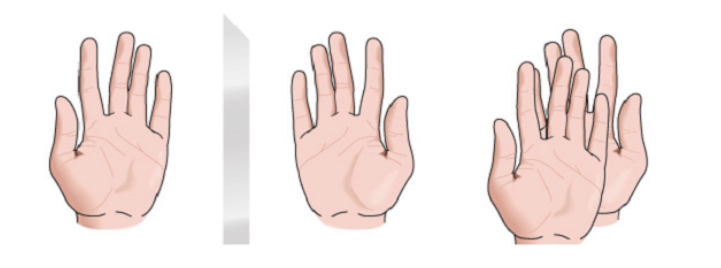
Есть и другие молекулы, похожие на пару носков. Носки являются зеркальным отображением друг друга, а также накладываются друг на друга.
Молекула или объект, накладываемый на свое зеркальное отражение, называется ахиральным .
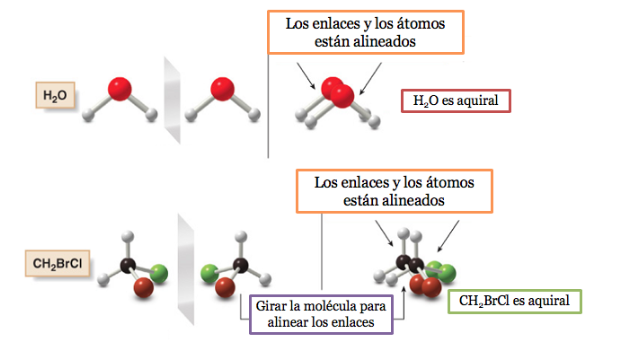
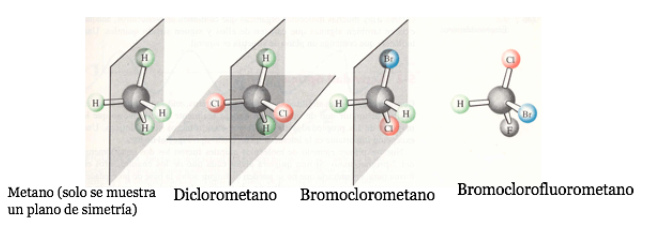
Если у молекулы есть плоскость симметрии, то это ахиральная система.
Хиральная молекула существует в двух стереоизомерных формах, называемых энантиомерами . Это несовместимые объекты со своими зеркальными отображениями.
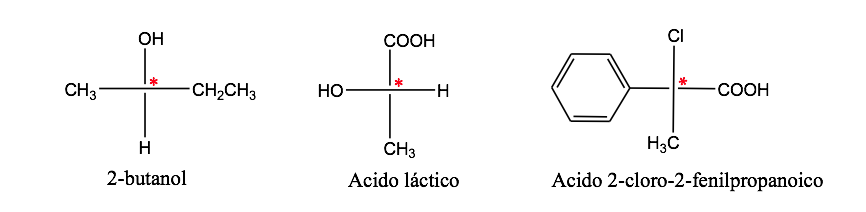
Атом углерода, присоединенный к 4 различным заместителям, называется асимметричным углеродом. Однако его существование не является гарантией хиральности (как будет видно позже). Также называется стереогенным углеродом или стереоцентром.
оптическая изомерия
Физические свойства двух энантиомеров идентичны: они имеют одинаковые температуры кипения и плавления, одинаковую растворимость, одинаковую плотность, один и тот же показатель преломления, одинаковую проводимость и т. д.
Оптическая активность пар энантиомеров является характерным свойством для их дифференциации.
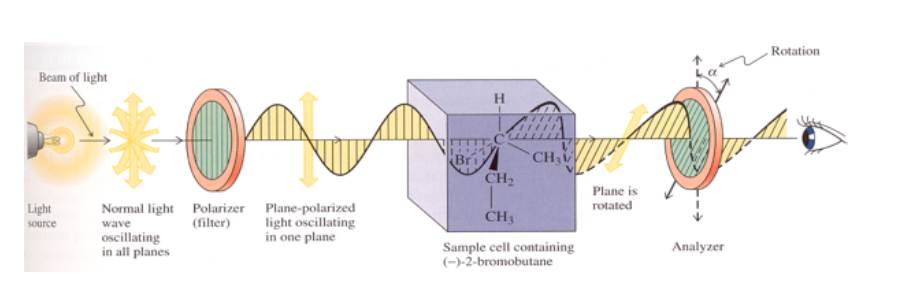
Если вещество оптически неактивно, изменения плоскости колебаний излучаемого поляризованного света не наблюдается.
Если вещество обладает оптической активностью, то наблюдается поворот на несколько градусов плоскости колебаний испускаемого поляризованного света.
Если вращение плоскости света происходит вправо (в том же направлении по часовой стрелке), то вещество правовращающее и величине α присваивается положительный знак.
Если вращение происходит влево (против часовой стрелки), вещество является левосторонним, и α присваивается отрицательный знак.
Удельное вращение оптически активной молекулы является характерной физической константой этой молекулы.

Удельное вращение некоторых хиральных соединений
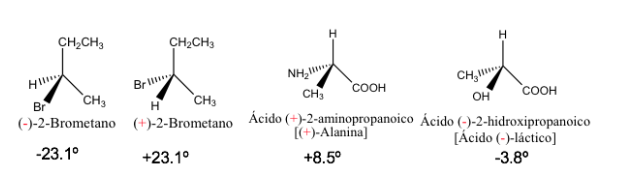
Чистые энантиомеры имеют такое же значение удельного вращения, но с противоположным знаком.
Следовательно, результирующее оптическое вращение смеси энантиомеров 1:1 равно нулю, т. е. она оптически неактивна. Такой тип смеси называется рацематом или рацемической смесью .
Наименование абсолютной конфигурации стереогенного центра основано на тех же правилах приоритета, разработанных Каном, Ингольдом и Прелогом .
Эти правила позволяют называть и описывать расположение в пространстве заместителей стереогенного центра независимо от знака оптического вращения молекулы.
Заместитель с самым низким приоритетом расположен как можно дальше от наблюдателя.
Если шаг от 1 до 2 и до 3 делается по часовой стрелке, хиральный центр R (прямая, латинское, вправо).
Если шаги с 1 по 2 по 3 выполняются против часовой стрелки, конфигурация хирального центра называется S (зловещая, латинская, левая).
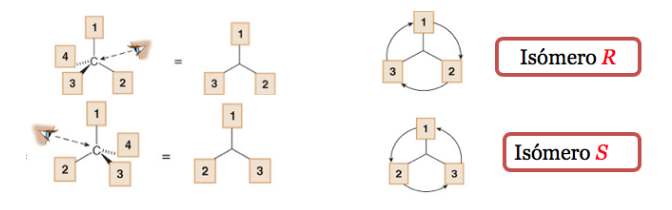
В систематической номенклатуре R или S добавляются в скобках в качестве префикса к названию хирального соединения.
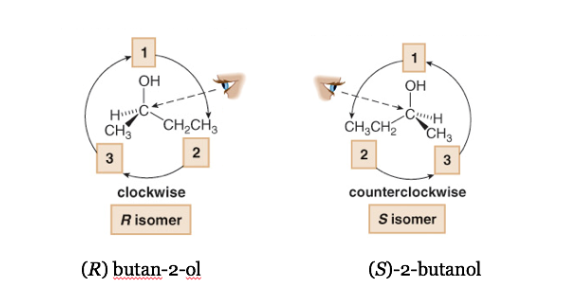
Важно помнить, что символы R и S не имеют никакой корреляции со знаком α .
Что делать, если молекула не ориентирована так, что группа с младшим приоритетом находится далеко?
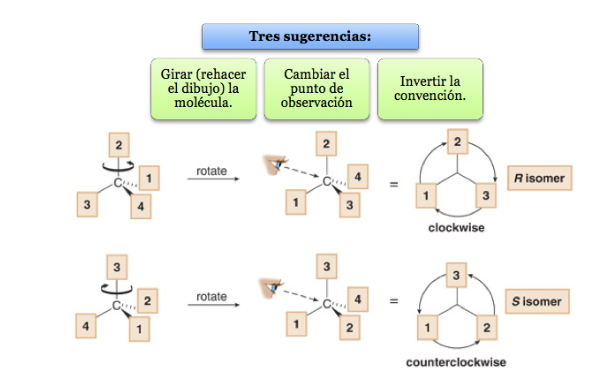
Соединение с n стереогенными центрами имеет максимум 2 n стереоизомера.
Пример:
Соединение с двумя стереогенными центрами имеет максимум 4 стереоизомера.
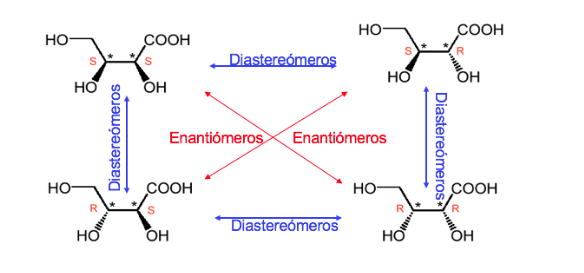
Любой стереоизомер, молекула которого не является хиральной, несмотря на наличие стереогенных центров, называется мезоформой или соединением.
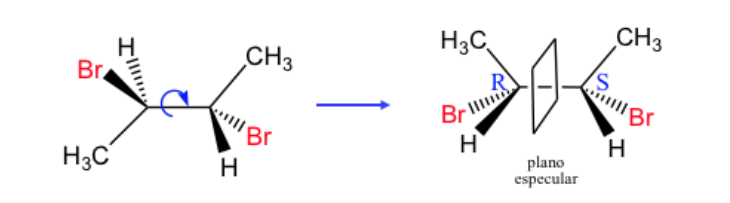
В соединении с двумя асимметричными атомами углерода доминирует , как если бы два атома углерода имели одинаковую абсолютную конфигурацию, так и в противоположном случае.
эритро- и трео-соединения
Когда два атома углерода имеют по крайней мере два одинаковых заместителя, можно использовать обозначения трео и эритро .
Пара эритроэнантиомеров - это пара, в которой идентичные группы могут быть помещены в затмеваемое положение.
Между номенклатурой R и S и номенклатурой Erythro/Treo нет прямой связи .
Когда два атома углерода имеют три одинаковых заместителя, эритроформа является мезо , поскольку она представляет собой плоскость симметрии.
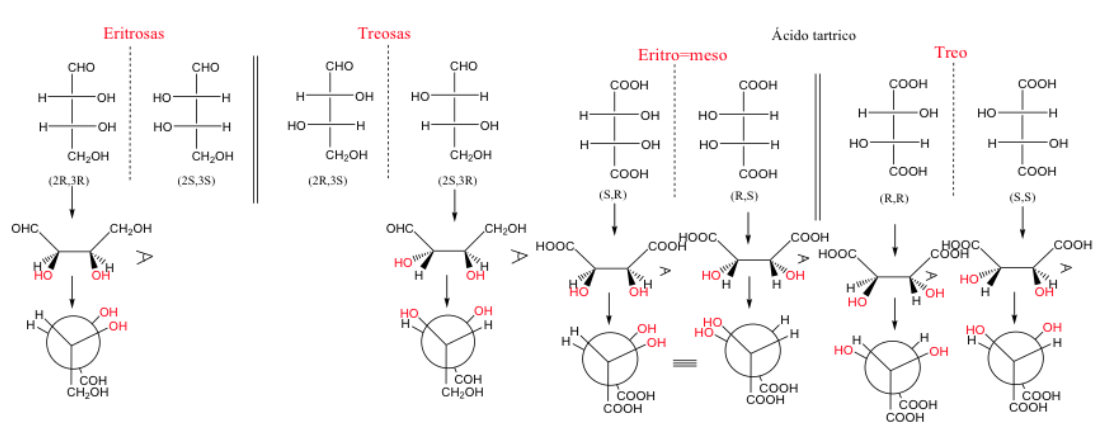
Молекула называется эритро , когда в ее представлении Фишера одинаковые или подобные группы находятся на одной стороне.
Молекула равна трем, если эти группы находятся на противоположных сторонах.
(обычно используется для сахаров (осас))
Это номенклатура, предшествующая номенклатуре R и S.
Сахар называется D , когда в проекции Фишера (с наиболее окисленным углеродом, расположенным сверху) гидроксил, связанный с асимметричным углеродом с наибольшим номером, находится справа.
Его энантиомер будет называться L и будет иметь эквивалент ОН слева.
Глюкоза и фруктоза в их естественных формах существуют как D.
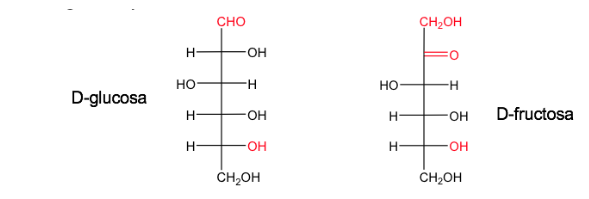
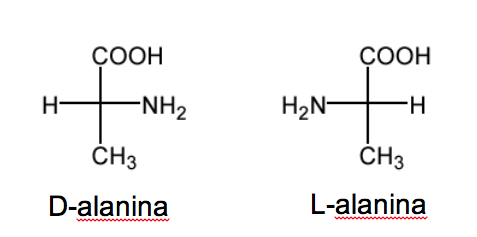
Номенклатура D/L также используется в ряду аминокислот.
RCH( NH2 )COOH.
В сахарах эта номенклатура зависит от положения гидроксила. В этом случае именно положение аминогруппы определяет номенклатуру. Когда в проекции Фишера (с наиболее окисленным углеродом вверху) группа NH 2 находится справа, эфироизомер представляет собой D , а ее энантиомер — L.
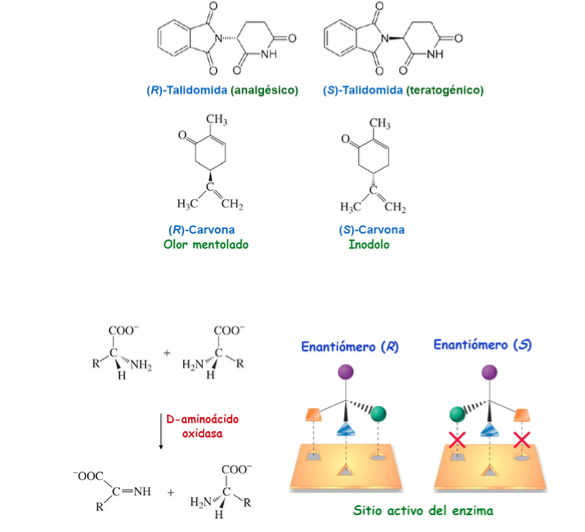
Важность хиральности
Источники для расширения поиска знаний:
1) Хуаристи Э. «Введение в стереохимию и конформационный анализ». СИНВЕСТАВ, Мексика, 1988 г. Хуаристи Э. . СИНВЕСТАВ, Мексика, 1994 г.
2) Нил С.И. «Физическая органическая химия» Лонгман, Милан, 1995.
3) Марч Дж., «Продвинутая органическая химия», John Wiley & Sons, Нью-Йорк, 1992 г. 4) Джонс РЭЙ «Физическая и механическая органическая химия», 2-е место. Издательство Эда Кембриджского университета, Кембридж, 1984.
5) Вудворд Р.Б. и Хоффманн Р. «Сохранение орбитальной симметрии», Academic Press, Нью-Йорк, 1979.
6) Карпентер Б.К. «Определение механизмов органических реакций», John Wiley & Sons, Нью-Йорк, 1984.









